Il s'agit d'un groupe de composés inorganiques formés par la combinaison de divers éléments avec de l'oxygène. Leur formule générale est X n O m , où "X" est n'importe quel élément, "O" est l'oxygène, toujours dans le deuxième état d'oxydation, et les lettres "n,m" dans l'indice inférieur sont des coefficients. Exemples d'oxydes : eau H 2 O, oxyde de potassium K 2 O, oxyde d'aluminium Al 2 O 3 , oxyde de calcium CaO et monoxyde de carbone (II) CO.

Classification des oxydes
Les oxydes peuvent être classés en plusieurs catégories. La classification la plus générale est la distinction entre les oxydes métalliques, par exemple l’oxyde de lithium, l’oxyde de magnésium, l’oxyde d’aluminium, l’oxyde de fer et les oxydes non métalliques, y compris l’oxyde de carbone, l’oxyde d’azote, l’oxyde de soufre et l’oxyde de chlore . Un autre critère est la classification selon leur état physique. Presque tous les oxydes métalliques et certains non-métaux (SiO 2 , P 4 O 10 ) sont des solides. L’eau, l’oxyde de soufre (VI) et l’oxyde de manganèse (VII) sont des liquides. Les oxydes non métalliques tels que CO, CO 2 , SO 2 , NO i NO 2 sont des gaz. Les oxydes peuvent également être classés en fonction du type de liaisons qui s’y produisent. L’oxyde de magnésium MgO, l’oxyde de calcium CaO ou l’oxyde de sodium Na 2 O contiennent des ions O 2- et des liaisons ioniques, d’où leur nom – oxydes ioniques. Un autre groupe comprend les oxydes covalents, par exemple le monoxyde de carbone (II) CO, l’oxyde nitrique (II) NO ou l’oxyde de soufre (IV) SO 2 , dans lesquels la liaison entre l’atome d’oxygène et l’élément a la forme d’une liaison covalente polaire.
Le caractère chimique des oxydes
Pour les chimistes, la classification la plus intéressante est basée sur la nature chimique des oxydes. Il existe quatre grandes catégories d’oxydes : acides, basiques, neutres et amphotères.
- Les oxydes acides , parfois également appelés anhydrides d’acides, se distinguent par le fait qu’ils réagissent avec les alcalis avec formation de sel. Une partie importante des oxydes acides forme des solutions appropriées d’ oxyacides après dissolution dans l’eau. Cela s’applique, par exemple, à l’oxyde de soufre (IV), qui, lorsqu’il est dissous dans l’eau, produit de l’acide sulfurique (IV) , et à l’oxyde de chrome (VI) qui se dissout en acide chromique (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Il existe un petit groupe d’oxydes acides insolubles dans l’eau. Cependant, ils sont solubles dans les solutions d’alcalis forts , par exemple le silicium ( IV) oxyde SiO 2 , oxyde de molybdène (VI) MoO 3 et oxyde de tungstène (VI) WO 3 . Leurs réactions avec les alcalis confirment leur caractère acide : SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O En règle générale, les oxydes acides sont des oxydes non métalliques et des oxydes métalliques à leurs états d’oxydation les plus élevés possibles. Si un élément donné forme plusieurs oxydes à différents états d’oxydation, comme par exemple le chrome, les propriétés acides de ses oxydes augmentent avec l’augmentation de son état d’oxydation :
- l’oxyde de chrome (II) CrO est alcalin,
- l’oxyde de chrome (III) Cr 2 O 3 a des propriétés amphotères,
- l’oxyde de chrome (VI) CrO 3 est acide.

- Les oxydes alcalins sont les composés de l’oxygène avec les métaux qui réagissent avec les acides pour donner des produits sous la forme des sels correspondants. Certains d’entre eux, à savoir les oxydes des éléments du premier et du deuxième groupe du tableau périodique, à l’exclusion du béryllium, se caractérisent également par une réaction avec l’eau entraînant la formation d’hydroxydes alcalins. Il se produit, par exemple, lors de la réaction de l’oxyde de sodium, de l’oxyde de lithium et de l’oxyde de baryum avec l’eau :
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Il existe également des oxydes alcalins qui ne se dissolvent pas dans l’eau mais uniquement dans des solutions acides. Ceux-ci comprennent, par exemple, l’oxyde de manganèse (II) et l’oxyde de fer (II) : MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Les oxydes neutres sont le groupe d’oxydes le moins réactif. Ils ne réagissent ni avec les acides ni avec les alcalis. Ils sont également insolubles dans l’eau. Des exemples de ce groupe d’oxydes sont le monoxyde de carbone (II) CO et l’oxyde nitrique (II) NO.
- Les oxydes amphotères sont à l’opposé des oxydes neutres et sont à la fois acides et alcalins. Cela signifie qu’ils réagissent à la fois avec les alcalis forts et les acides. Les produits de ces réactions sont toujours des sels, et l’élément initialement combiné avec l’oxygène est transformé en un cation ou anion approprié du résidu acide. La seule similitude avec les oxydes neutres est leur faible solubilité dans l’eau. Des exemples d’oxydes amphotères sont : l’oxyde de béryllium BeO, l’oxyde d’aluminium Al 2 O 3 , l’oxyde de chrome (III), l’oxyde d’étain (II) SnO, l’oxyde de plomb (II) PbO et l’oxyde de zinc ZnO. En réagissant avec des solutions aqueuses d’alcalis forts, par exemple avec une solution aqueuse d’ hydroxyde de sodium , ils forment des sels complexes . Dans leurs résidus acides, des atomes ou des ions du métal, qui est dérivé de l’oxyde, sont présents dans des complexes avec un nombre approprié de groupes hydroxyle. Leur nombre dépend du numéro de coordination de l’élément donné. Par exemple, les atomes dérivés d’oxydes MO (M – métal), tels que l’oxyde de béryllium BeO, ont le numéro de coordination 4. Les atomes dérivés d’oxydes de type M 2 O 3 , par exemple Al 2 O 3 , peuvent avoir deux numéros de coordination différents, et selon les conditions de réaction il est de 4 ou 6. Exemples de réactions d’oxydes amphotères :
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] tétrahydroxy zincate de sodium Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] tétrahydroxyaluminate de potassium Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] hexahydroxyaluminate de sodium Certains oxydes , comme l’oxyde de zinc et l’oxyde de manganèse (IV), ont des propriétés amphotères bien particulières. Ce dernier, ni dans des conditions normales ni standard, ne réagit pas avec les alcalis. Les deux, en revanche, réagissent avec eux en fusionnant avec des alcalis solides, par exemple : 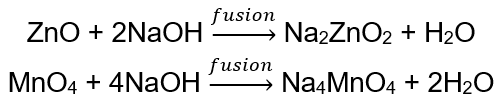

Obtention d’oxydes
- Synthèse directe d’éléments : a) synthèse d’atomes de soufre et d’atomes d’oxygène avec formation d’oxyde de soufre (IV) S + O → SO 2 b) synthèse d’atomes de magnésium et d’atomes d’oxygène avec formation d’oxyde de magnésium 2Mg + O 2 → 2MgO c) synthèse d’atomes de carbone et d’atomes d’oxygène avec formation de monoxyde de carbone (IV) C + O 2 → CO 2
- Décomposition thermique des sels , hydroxydes et oxydes : a) décomposition du carbonate de calcium en oxyde de calcium et monoxyde de carbone (IV) CaCO 3 → CaO + CO 2 b) décomposition de l’hydroxyde de cuivre (II) en oxyde de cuivre (II) et eau Cu( OH) 2 → CuO + H 2 O c) décomposition de l’oxyde de manganèse (IV) en oxyde de manganèse (III) et oxygène 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxydation des oxydes à des états d’oxydation inférieurs, avec une augmentation de leur valence : a) oxydation de l’oxyde de soufre (IV) en oxyde de soufre (VI) 2SO 2 + O 2 → 2SO 3 b) oxydation de l’oxyde nitrique (II) en nitrique ( IV) oxyde 2NO + O 2 → 2NO 2 c) oxydation du monoxyde de carbone (II) en monoxyde de carbone (IV) (IV) 2CO + O 2 → 2CO 2
- Réduction des oxydes à des états d’oxydation plus élevés, avec une diminution de leur valence : a) réduction du monoxyde de carbone (IV) en monoxyde de carbone (II) (II) CO 2 + C → 2CO b) réduction de l’oxyde d’étain (II) en étain (I) oxyde 2SnO + O 2 → 2SnO 2
- Combustion de composés organiques : a) combustion du méthane dans l’oxygène avec formation de monoxyde de carbone (IV) et d’eau CH 4 + 2O 2 → CO 2 + 2H 2 O b) combustion de l’ammoniac dans l’oxygène pour obtenir de l’oxyde nitrique (II) et eau 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Réaction des oxyacides instables : a) décomposition de l’acide carbonique (IV) en monoxyde de carbone (IV) et eau : H 2 CO 3 → CO 2 + H 2 O b) décomposition de l’acide sulfurique (IV) en oxyde de soufre (IV) et eau : H 2 SO 3 → SO 2 + H 2 O
