L'électronégativité est une quantité qui reflète la tendance d'un atome donné au sein d'une molécule à attirer des électrons vers lui. En pratique, il s’agit de la capacité d’un atome ou de groupes fonctionnels à attirer la densité électronique. L'échelle la plus couramment utilisée associée à cette quantité est celle introduite par Linus Pauling, qui permet de calculer facilement la nature approximative de la liaison.

Caractéristiques d’électronégativité
Les molécules homonucléaires, par exemple H 2 et O 2 , ont des coefficients égaux c A et c B dans leurs orbitales moléculaires, qui peuvent être enregistrés sous forme de fonctions d’onde : Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B Dans ce cas, l’orbitale est caractérisée par sa forme symétrique par rapport au centre de la molécule et sa charge électrique est également répartie symétriquement en son sein. Cependant, un autre exemple est celui des molécules hétéronucléaires, dans lesquelles il est pratiquement impossible de maintenir des coefficients égaux, ainsi qu’une symétrie complète par rapport au centre de la molécule. Lorsque le niveau d’énergie de l’orbitale atomique Ψ B est inférieur au niveau d’énergie de l’orbitale atomique Ψ A , la relation se produit et le maximum de la densité de probabilité électronique est déplacé vers l’atome B. En pratique, cela se traduit par un déplacement de l’électron. paire dans la liaison chimique, c’est-à-dire polarisation vers l’atome B. Par exemple, dans la molécule d’hydrure de lithium LiH, ce déplacement se fait vers l’atome d’hydrogène, tandis que dans la molécule de fluorure d’hydrogène HF, il se fait vers l’atome de fluor. Cela signifie que l’atome d’hydrogène a un niveau d’énergie inférieur à celui du lithium, mais un niveau d’énergie supérieur à celui du fluor (lire à propos des halogènes ). Dans ces conditions, l’un des atomes des deux molécules prend une charge négative notée -δ et l’autre est positive +δ. La formule générale d’une telle molécule est A +δ B -δ .
Charges d’atomes
La charge δ précitée peut prendre différentes valeurs selon les éléments liés par la liaison chimique . Sa valeur de 0 signifie que la charge de la paire d’électrons est distribuée symétriquement et que la paire est située complètement à proximité de l’atome avec un niveau d’énergie inférieur, ce qui entraîne le transfert des deux électrons vers cet atome. Cela crée une liaison ionique entre les éléments. Cependant, dans la grande majorité des liaisons chimiques, il existe des charges fractionnaires, ce qui entraîne un état intermédiaire entre la liaison covalente et la liaison ionique.
Moment dipolaire
Un dipôle est une molécule dans laquelle on distingue deux pôles, positif et négatif. Le moment dipolaire, noté μ, est une mesure de l’ampleur du déplacement de charge électrique dans celui-ci. Elle se définit comme le produit de la valeur absolue de la charge électrique (δ) contenue dans l’un des pôles et de la distance à ces pôles (l) : μ = δ · l Une charge positive (δ+) et une charge négative ( δ-) est appelée charge partielle et sa localisation est attribuée à un atome particulier, mais en réalité il ne s’agit que de la probabilité plus ou moins grande qu’un électron soit présent autour de ses noyaux. Un tel phénomène est parfois confondu avec les processus d’ oxydation et de réduction , mais contrairement aux changements qui s’y produisent, de telles charges prises par les atomes ne les font pas passer à un autre état d’oxydation, il n’y a donc pas d’échange d’électrons entre eux. eux. L’unité SI pour exprimer le moment dipolaire est le coulomb mètre (C·m). Cependant, dans les calculs, l’unité écrite dans le système CGS, le debye (D), est la plus couramment utilisée. Un débye correspond à une valeur de 3,33564·10 -30 C·m. Le moment dipolaire le plus grand théoriquement possible caractérise les molécules avec une liaison purement ionique. Alors que le plus petit se produit dans les molécules dont la liaison est purement covalente – le moment dipolaire est nul dans ce cas. Cependant, la plupart sont des cas intermédiaires avec des caractères de particules variables.
Moment dipolaire halogène
Plusieurs relations entre l’électronégativité et le moment dipolaire peuvent être facilement observées sur des composés chimiques spécifiques. Tableau 1 Moments dipolaires des halogénures d’hydrogène
| Composé | Moment dipolaire déterminé expérimentalement [ μ, D] | Longueur de la liaison [pm] | Produit de la charge élémentaire et de la longueur du dipôle [e ·l, D] | Part du caractère ionique [ %] | Différence d’électronégativité de l’halogène et de l’hydrogène |
| HF | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6h15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| SALUT | 0,38 | 162 | 7,78 | 5 | 0,4 |
Le rapport μ/(e·l’), c’est-à-dire le moment dipolaire réel par rapport au moment dipolaire qui correspond à une liaison ionique, peut fournir une mesure des écarts par rapport à la liaison entièrement covalente. Le produit de cette relation sous la forme de (μ/(e.l’))·100%représente le pourcentage du caractère ionique dans la liaison. Il ne s’agit que d’une valeur approximative, car le moment dipolaire dépend non seulement de la polarité de la liaison, mais aussi du comportement des paires d’électrons libres. Il arrive que le nuage électronique puisse être déplacé vers l’extérieur de la molécule, la conséquence étant que l’équation permettant de déterminer son moment dipolaire comporte une composante supplémentaire. Dans le cas de la molécule d’ammoniac, le nuage est dirigé conformément au moment dipolaire de la liaison, ce qui entraîne une augmentation du moment dipolaire résultant. En revanche, l’inverse est vrai pour la molécule de monoxyde de carbone, où le nuage est dirigé dans la direction opposée et réduit par conséquent le moment dipolaire résultant. 
Électronégativité
Il s’agit d’une quantité empirique sans dimension qui reflète la tendance d’un atome donné au sein d’une molécule à attirer des électrons vers lui. En pratique, il s’agit de la capacité d’un atome ou de groupes fonctionnels à attirer la densité électronique. L’échelle la plus couramment utilisée associée à cette quantité est celle introduite par Linus Pauling, qui permet de calculer facilement la nature approximative de la liaison. Le scientifique a utilisé la méthode suivante pour calculer l’électronégativité des éléments individuels : Nous supposons que D AA et D BB sont les énergies de liaison des molécules à deux atomes (A 2 , B 2 ). Nous désignons l’énergie de liaison qui se produit dans la molécule par D AB . Empiriquement, il a été montré que si une telle liaison contient peu ou pas de caractère ionique, la différence entre les valeurs D AB et la moyenne géométrique des valeurs d’énergie D AA et D BB est égale ou proche de zéro. Lorsque la liaison AB présente des écarts nets par rapport au caractère covalent, cette différence prend des valeurs positives, qui augmentent à mesure que la proportion du caractère ionique augmente. La différence entre l’électronégativité (x) des deux atomes impliqués dans la liaison est exprimée par la formule : ![]() Par conséquent, si Pauling a supposé une électronégativité du fluor de 4,0 dans ses calculs, il est possible de calculer les électronégativités ultérieures des éléments. Si nous connaissons la valeur x A des atomes de l’élément A et la valeur du coefficient Δ’ alors nous pouvons calculer la valeur x B en utilisant l’équation ci-dessus. L’échelle de Pauling est construite de telle manière que ses valeurs concordent approximativement avec les valeurs du moment dipolaire de la liaison formée par les atomes considérés, comme le montre l’exemple du tableau 1, qui contient les valeurs déterminées pour les halogénures d’hydrogène. . En plus de l’échelle décrite ci-dessus, il en existe plusieurs autres décrites dans la littérature scientifique, notamment l’électronégativité décrite par :
Par conséquent, si Pauling a supposé une électronégativité du fluor de 4,0 dans ses calculs, il est possible de calculer les électronégativités ultérieures des éléments. Si nous connaissons la valeur x A des atomes de l’élément A et la valeur du coefficient Δ’ alors nous pouvons calculer la valeur x B en utilisant l’équation ci-dessus. L’échelle de Pauling est construite de telle manière que ses valeurs concordent approximativement avec les valeurs du moment dipolaire de la liaison formée par les atomes considérés, comme le montre l’exemple du tableau 1, qui contient les valeurs déterminées pour les halogénures d’hydrogène. . En plus de l’échelle décrite ci-dessus, il en existe plusieurs autres décrites dans la littérature scientifique, notamment l’électronégativité décrite par :
- Mulliken, dont les travaux supposaient que l’électronégativité d’un élément est directement proportionnelle à la somme de son affinité électronique et de son énergie d’ionisation. L’affinité électronique, qui est la quantité d’énergie libérée en raison de l’attachement d’un électron à un atome neutre, et l’énergie d’ionisation égale à la quantité d’énergie nécessaire pour détacher un électron d’un atome neutre. Les électronégativités les plus élevées sont donc caractéristiques des atomes qui présentent une affinité électronique élevée et une énergie d’ionisation élevée.
- Allred et Rochow, qui ont supposé la proportionnalité de l’électronégativité à la mesure de la force avec laquelle le noyau atomique (Z) agit sur les électrons de valence, ont été enregistrés comme
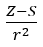 (r – rayon atomique, S – constante de filtrage). Selon leur théorie, l’électronégativité (x) des éléments peut être calculée à l’aide de la formule :
(r – rayon atomique, S – constante de filtrage). Selon leur théorie, l’électronégativité (x) des éléments peut être calculée à l’aide de la formule :
![]() À chaque échelle, l’électronégativité de l’hydrogène est proche de la valeur de 2,2, les autres valeurs variant légèrement. Des exemples d’électronégativités d’atomes élémentaires calculées selon les échelles de Pauling, Mulliken et Allred et Rochow sont présentés dans le tableau 2 ci-dessous. Tableau 2 Electronégativités d’exemples d’éléments sur les échelles de Pauling (P), Mulliken (M) et Allred et Rochow (AR)
À chaque échelle, l’électronégativité de l’hydrogène est proche de la valeur de 2,2, les autres valeurs variant légèrement. Des exemples d’électronégativités d’atomes élémentaires calculées selon les échelles de Pauling, Mulliken et Allred et Rochow sont présentés dans le tableau 2 ci-dessous. Tableau 2 Electronégativités d’exemples d’éléments sur les échelles de Pauling (P), Mulliken (M) et Allred et Rochow (AR)
| Atome | P. | M. | RA |
| F | 3,98 | 3,90 | 4.10 |
| Ô | 3.44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2.25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Malgré les divergences dans les calculs des trois méthodes, le fluor présente l’électronégativité la plus élevée à chaque échelle, suivi de l’oxygène, de l’azote et du chlore . Les valeurs les plus basses ont été déterminées pour le francium, le césium, le rubidium et le potassium. Les éléments qui sont généralement des non-métaux ont des électronégativités supérieures à la valeur de 2, les métaux typiques ont des électronégativités inférieures à 2. La valeur standard est l’électronégativité susmentionnée de l’hydrogène d’environ 2,2. 
Electronégativité dans le tableau périodique
Comme beaucoup d’autres propriétés, l’électronégativité se reflète également dans la disposition des éléments chimiques sur le tableau périodique . Dans le groupe, l’électronégativité diminue avec l’augmentation du nombre de coquilles et du caractère métallique, elle augmente donc dans la direction du francium vers l’hydrogène. Au fil du temps, l’électronégativité augmente avec une augmentation des électrons de valence présents et une diminution du caractère non métallique, donc des métaux aux gaz rares .
Electronégativité et type de liaison – résumé
En connaissant les valeurs individuelles de l’électronégativité des éléments qui forment la liaison chimique, on peut en déduire la nature. Si la différence est comprise entre 0,0 et 0,4, la liaison est covalente. Lorsque la différence est comprise entre 0,4 et 1,7, la liaison est polarisée de manière covalente. Une différence supérieure à 1,7 dans l’électronégativité des éléments suggère une liaison ionique.
