Les méthodes spectroscopiques sont un groupe de méthodes dans lesquelles le signal est produit par l'interaction d'un rayonnement électromagnétique ou corpusculaire avec l'échantillon examiné. Ce rayonnement peut résulter de changements périodiques du champ électromagnétique associés au transfert d’énergie. Ces méthodes sont utilisées pour déterminer la concentration ou le contenu des atomes dans un système absorbant ou émetteur donné. Quels types de spectrophotométrie existe-t-il et qu’impliquent ces méthodes ? C’est ce que vous découvrirez dans notre article.

Transitions radiologiques et énergétiques
La propriété la plus importante des photons, ou quanta de rayonnement, est l’énergie. La formule de la valeur énergétique (E) est le produit de la constante de Planck (h) de 6,626·10 -34 [J ·s] et de la fréquence de rayonnement (v) exprimée en Hertz [Hz]. 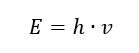 La spectrophotométrie utilise les transitions énergétiques dans les molécules, provoquées par l’absorption ou l’émission de rayonnements électromagnétiques dans différentes plages :
La spectrophotométrie utilise les transitions énergétiques dans les molécules, provoquées par l’absorption ou l’émission de rayonnements électromagnétiques dans différentes plages :
- ultraviolet (UV) 200-380 nm,
- rayonnement visible (Vis) 380-780 nm,
- proche infrarouge (IR) 0,78-30 000 μm.
Concepts de base et lois de la spectrophotométrie
Point isobestique
Il s’agit du point correspondant à une longueur d’onde spécifique résultant de l’intersection des courbes tracées dans le système absorbance-longueur d’onde, où les deux formes du composé en solution (dissociées et non dissociées) ont une absorption égale. Un changement de pH ne change pas la position, un composé peut avoir plusieurs de ces points.
Spectre d’absorption d’un composé chimique
Le spectre est une mesure de la quantité de lumière absorbée par le composé à partir de la longueur d’onde lumineuse (λ). Si un rayonnement électromagnétique (lumière) d’intensité I 0 tombe sur un échantillon, une partie de ce rayonnement sera absorbée et une autre traversera l’échantillon. En enregistrant les intensités du rayonnement incident (I 0 ) et transmis (I t ), nous pouvons déterminer la quantité de lumière qui est absorbée par la solution (absorbance, A) ou qui l’a traversée (transmittance, T).
Absorbance
La grandeur qui décrit le phénomène d’absorption est l’absorbance. Il s’agit d’une mesure sans dimension de l’intensité du rayonnement électromagnétique par rapport au nombre d’atomes libres. Ce chiffre a été introduit pour faciliter les calculs liés aux volumes d’absorption. L’absorption est l’interaction entre le rayonnement électromagnétique et la matière – l’absorption d’une partie de l’énergie par la matière. L’absorbance est additive et est parfois appelée densité optique. Symboliquement, il est enregistré comme Abs ou A. Mathématiquement, c’est le logarithme décimal du rapport de l’intensité du faisceau de rayonnement incident sur l’échantillon d’essai (I 0 ) à l’intensité du faisceau de rayonnement transmis à travers l’échantillon d’essai. ( Il ). Il peut prendre des valeurs de 0 à l’infini. L’expression mathématique décrivant cette relation est appelée loi de Beer-Lambert. L’absorbance à une longueur d’onde donnée dépend du coefficient d’absorption (ε), de l’épaisseur de la couche absorbante (généralement 1 cm) et de la concentration de la solution d’essai.
Transmission
La transmittance est le rapport entre l’irradiance traversant l’échantillon (I t ) et l’irradiance incidente sur l’échantillon (I 0 ), qui est égale à l’irradiance traversant la référence. Elle est le plus souvent exprimée en pourcentage et peut varier de 0 %à 100 %. Elle s’exprime par la formule : 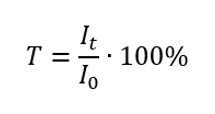 La relation entre l’absorbance et la transmission s’exprime comme suit :
La relation entre l’absorbance et la transmission s’exprime comme suit : 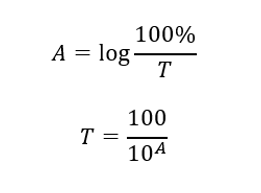
Loi Lambert
Il dit que l’absorbance est proportionnelle à l’épaisseur de la couche absorbante d’un échantillon homogène. Il peut être enregistré comme le quotient du coefficient d’absorption (k) et de l’épaisseur de la couche d’échantillon mesurée (l) : 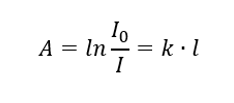

Loi Beer-Lambert
Elle concerne l’absorption du rayonnement par les solutions et peut être formulée ainsi : si le coefficient d’absorption du solvant est nul, alors l’absorbance d’un faisceau de rayonnement monochromatique traversant une solution homogène est directement proportionnelle à la concentration (c) de la solution. et à l’épaisseur de la couche absorbante (l). La loi de Beer-Lambert est la définition de l’absorbance et peut s’écrire comme suit : 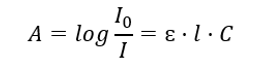 Le coefficient d’absorption molaire (ɛ) est une valeur caractéristique d’une substance dans un solvant particulier et à une longueur d’onde particulière. Elle est proportionnelle à la probabilité de transitions entre les niveaux d’énergie de la molécule et dépend directement de l’énergie des photons du rayonnement. En termes numériques, il représente l’absorbance présentée par une solution avec une concentration de 1 mol/dm 3 , avec une épaisseur de couche absorbante de 1 cm. Connaître le coefficient permet de déterminer la concentration de la solution à tester après avoir mesuré l’amplitude de l’absorbance. En option, l’absorbance attendue de la solution peut également être calculée à partir du coefficient et de la concentration. La formule est principalement utilisée pour déterminer la concentration d’une substance avec un coefficient d’absorption molaire connu et une absorbance mesurée empiriquement. Cela peut être fait à l’aide d’une formule ou en traçant une courbe d’étalonnage pour la substance en plusieurs points dans la plage de concentration attendue. La loi de Beer-Lambert peut également être présentée comme une dépendance de l’absorption à la concentration : A = f(C).
Le coefficient d’absorption molaire (ɛ) est une valeur caractéristique d’une substance dans un solvant particulier et à une longueur d’onde particulière. Elle est proportionnelle à la probabilité de transitions entre les niveaux d’énergie de la molécule et dépend directement de l’énergie des photons du rayonnement. En termes numériques, il représente l’absorbance présentée par une solution avec une concentration de 1 mol/dm 3 , avec une épaisseur de couche absorbante de 1 cm. Connaître le coefficient permet de déterminer la concentration de la solution à tester après avoir mesuré l’amplitude de l’absorbance. En option, l’absorbance attendue de la solution peut également être calculée à partir du coefficient et de la concentration. La formule est principalement utilisée pour déterminer la concentration d’une substance avec un coefficient d’absorption molaire connu et une absorbance mesurée empiriquement. Cela peut être fait à l’aide d’une formule ou en traçant une courbe d’étalonnage pour la substance en plusieurs points dans la plage de concentration attendue. La loi de Beer-Lambert peut également être présentée comme une dépendance de l’absorption à la concentration : A = f(C).
Loi de l’additivité
La loi de Beer-Lambert fait référence au cas où il y a une substance absorbante en solution. Cependant, s’il y a plus de substances dans une solution à plusieurs composants qui absorbent le rayonnement à une longueur d’onde sélectionnée, l’absorbance de cette solution (A) est égale à la somme des absorbances de ses composants individuels (A 1 , A 2 ,…), c’est-à-dire UNE=UNE 1 +UNE 2 +⋯+UNE n . Il convient de noter et de rappeler que l’absorbance de chaque composant est le produit de sa concentration et du coefficient d’absorption molaire correspondant. Il s’agit de la 3ème loi d’absorption, utilisée dans l’analyse spectrophotométrique des systèmes multicomposants.
Écarts par rapport aux lois de l’absorption
Une condition préalable au respect des lois de l’absorption est que le rayonnement agissant sur le système soit monochromatique et que son intensité ne soit pas trop élevée. Les raisons de s’écarter de la loi Beer-Lambert peuvent être :
- imperfection des instruments de mesure, entraînant le non-respect de la condition,
- réactions chimiques se produisant pendant la mesure, par exemple polymérisation , hydrolyse, condensation,
- turbidité de la solution.
Application des spectres d’absorption électronique
- Il permet de déterminer le type de transitions électroniques en examinant les spectres dans des solvants de polarité différente.
- Les différences de position et d’intensité des bandes d’absorption des différentes formes moléculaires permettent d’étudier les équilibres établis entre elles dans la solution ( études structurales , équilibres tautomériques).
- Utilisé pour la détermination des composés basée sur la loi Beer-Lamber.
- Utilisé comme méthode d’identification supplémentaire basée sur la position λ max des substances d’essai.
- Utilisé dans la détermination de la pureté des composés testés – déplacement de la position maximale d’absorption, comparaison du rapport des valeurs d’absorbance à deux points différents du spectre.

Spectroscopie électronique UV-Vis
En termes de phénomène d’absorption, la spectrophotométrie UV-Vis est une technique particulièrement intéressante, permettant l’analyse qualitative et quantitative de nombreuses substances. Le phénomène d’absorption du rayonnement est utilisé lorsque : l’absorption dépend linéairement de la concentration ou lorsque l’absorption est additive, c’est-à-dire pour une solution multicomposants, elle est la somme des absorptions de ses composants. Les conditions sont remplies lorsqu’il n’y a pas d’interactions intermoléculaires dans le système. En analysant les spectres d’absorption UV-Vis résultant du passage du rayonnement électromagnétique à travers la solution, des transitions d’électrons de valence du sol vers l’état excité sont observées. Ce phénomène se traduit par l’absorption d’une partie du rayonnement à certaines longueurs d’onde. L’absorption est la conséquence de la transition de ces électrons vers des niveaux d’énergie plus élevés, mais pour que cela se produise, les quanta de rayonnement électromagnétique doivent avoir suffisamment d’énergie pour équilibrer la différence d’énergie entre les niveaux d’énergie. Dans les molécules, ces énergies sont de quelques électronvolts, ce qui correspond précisément à la fréquence UV-Vis.
Chromophores
Les composés qui présentent une absorption dans la gamme UV-Vis ont dans leur structure des chromophores, c’est-à-dire des groupes d’atomes dont les électrons sont caractérisés par de faibles énergies d’excitation. En d’autres termes, un chromophore est la partie d’une molécule (groupe d’atomes) responsable de l’absorption sélective du rayonnement dans le domaine visible (180-800 nm) et donc de l’apparition de la couleur. Ceux-ci incluent : les anneaux aromatiques (sextet d’électrons aromatiques), les liaisons multiples (dont une partie est des liaisons de type π), à la fois entre les atomes de carbone et d’autres, comme le groupe carbonyle C=O.
Auxochromes
Un autre groupe d’atomes sont les auxochromes, c’est-à-dire les substituants qui ne présentent pas d’absorption dans la gamme UV-Vis, mais leur présence provoque des changements dans le spectre des éléments absorbants. Ils renforcent l’action des chromophores, ce que l’on peut souvent observer sous la forme d’une coloration beaucoup plus intense de la substance à tester qu’en cas de leur absence dans le système. De plus, nous divisons les auxochromes en bathochromes , par exemple –NH 2 , -OH, qui déplacent le maximum d’absorption vers des longueurs d’onde plus longues, et en hypsochromes , tels que –CH 3 , -CO, qui déplacent le maximum vers des longueurs d’onde plus courtes.
Spectroscopie d’absorption atomique (AAS)
Il s’agit d’une autre technique utilisant le phénomène d’absorption. Il est utilisé pour déterminer des éléments chimiques sous forme d’échantillons dans n’importe quel état (liquide, solide, gaz) et la mesure elle-même est basée sur l’observation de l’absorption d’un rayonnement d’une longueur d’onde spécifique par des atomes métalliques libres. La base de la technique est qu’un atome ne peut absorber un rayonnement électromagnétique qu’à une longueur d’onde à laquelle il peut également l’émettre, et ceci n’est caractéristique que de l’élément donné. Avec une énergie plus élevée fournie à l’atome, les électrons sont excités à des niveaux plus élevés et un plus grand nombre de raies est observé dans le spectre. Si l’énergie fournie correspond au potentiel d’ionisation de l’atome, des ions tels que Na + se forment. La base de l’analyse quantitative par spectrométrie d’absorption atomique est la proportionnalité de l’absorbance par rapport au nombre d’atomes absorbants et la loi de Beer-Lambert.
























































































































