La stœchiométrie est la branche de la chimie générale qui traite des calculs concernant le déroulement quantitatif des réactions chimiques. Lorsqu'on travaille en laboratoire, il est très souvent nécessaire de savoir quelle quantité (masse, volume, molécules) des substrats nous devons utiliser pour que la réaction chimique que nous effectuons se déroule complètement ou pour obtenir la quantité de produit nous voulons. Parfois, il est également nécessaire de calculer l’excès ou le manque de substrat qui a entraîné un déroulement différent de celui prévu de l’expérience. Chacun de ces calculs découle directement de l'interprétation quantitative de l'équation de la réaction chimique et utilise les lois de conservation de la masse. Ces types d'équations sont appelés calculs stœchiométriques.

Qu’est-ce qu’on a besoin de savoir?
Pour utiliser la stœchiométrie, nous devons avoir des connaissances dans un certain nombre de domaines, notamment : les équations de réactions chimiques, les coefficients stœchiométriques, les masses molaires et molaires et les volumes molaires des gaz et la loi d’Avogadro . Grâce à la connaissance de la stœchiométrie des réactions chimiques, de nombreux problèmes de calcul peuvent être résolus, tels que :
- analyse élémentaire,
- calculs molaires,
- calculs de masse,
- calcul de mélanges non stœchiométriques avec possibilité de déterminer la substance limitante de la réaction,
- rendement de la réaction.
Masse molaire
En raison de la masse incroyablement petite des atomes et molécules individuels, l’ unité (u) , exprimant la masse atomique, a été créée. En pratique, il s’agit d’une valeur égale à 1/12 de la masse de l’isotope du carbone 12 C. Cette portion d’une substance est étroitement liée à la constante d’Avogadro et est déterminée comme le nombre de grammes d’une substance qui contient 6,022·10 23 atomes, molécules ou ions. La masse molaire [M] est numériquement égale à la masse atomique ou moléculaire et l’unité est g/mol.
Volume molaire de substance [Vm]
Il s’agit d’une valeur spécifique à la substance qui dépend fortement des conditions de température et de pression. C’est le volume de substance occupé par une mole de celle-ci. Dans des conditions normales, une valeur constante de 22,4 dm 3 est adoptée.
Loi de composition constante et conservation de la masse
Tout composé chimique, quelle que soit son origine et son mode d’obtention, a une composition qualitative et quantitative bien définie et constante. L’oxyde de soufre (IV), par exemple, contient toujours 50 %en poids de soufre et l’oxyde de soufre (VI) 40 %en poids de cet élément. Dans un système fermé, la masse des produits résultants est égale à la masse des substrats consommés lors de la réaction. La loi de conservation de la masse se reflète dans la nécessité d’équilibrer chaque équation de réaction chimique avec les coefficients chimiques appropriés afin que les deux côtés de l’équation soient égaux en termes de nombre d’atomes présents. Les rapports stœchiométriques reflètent les rapports molaires des réactifs présents dans la réaction chimique.
Équation de réaction chimique
Toutes les informations nécessaires sur les relations relatives entre les substances chimiques proviennent de leur équation de réaction chimique. Il fournit des informations relatives et quantitatives importantes.
Exemple 1.
De l’équation de synthèse de l’ ammoniac , qui suit la réaction : ![]() nous pouvons effectuer plusieurs interprétations – moléculaires, molaires, masses molaires, volumes molaires et nombres moléculaires. a) Moléculairement, on peut lire que trois molécules d’hydrogène réagissent avec une molécule d’azote pour former deux molécules d’ammoniac. b) Cela signifie également que trois moles d’hydrogène réagissent avec une mole d’azote pour former le produit de deux moles d’ammoniac. c) En utilisant le tableau périodique des éléments chimiques , qui contient les masses molaires des atomes individuels, nous pouvons également conclure de l’équation que 6 g d’hydrogène ont complètement réagi avec 28 g d’azote pour former 34 g d’ammoniac. d) Alors, dans des conditions normales, on sait qu’une mole de gaz occupe 22,4 dm 3 . Cela permet de conclure que 67,2 dm 3 d’hydrogène réagissent avec 22,4 dm 3 d’azote pour former 44,8 dm 3 d’ammoniac. e) Une autre relation utile est la loi d’Avogadro, qui stipule que des volumes égaux de gaz différents contiennent le même nombre de particules dans les mêmes conditions de pression et de température. Connaissant la constante d’Avogadro de 6,022·10 23 , nous savons qu’il nous faut 3·6,022·10 23 molécules d’hydrogène et 6,022·10 23 molécules d’azote pour réaliser la réaction chimique complète de synthèse de l’ammoniac. La réaction donne 2,022,10 23 molécules d’ammoniac.
nous pouvons effectuer plusieurs interprétations – moléculaires, molaires, masses molaires, volumes molaires et nombres moléculaires. a) Moléculairement, on peut lire que trois molécules d’hydrogène réagissent avec une molécule d’azote pour former deux molécules d’ammoniac. b) Cela signifie également que trois moles d’hydrogène réagissent avec une mole d’azote pour former le produit de deux moles d’ammoniac. c) En utilisant le tableau périodique des éléments chimiques , qui contient les masses molaires des atomes individuels, nous pouvons également conclure de l’équation que 6 g d’hydrogène ont complètement réagi avec 28 g d’azote pour former 34 g d’ammoniac. d) Alors, dans des conditions normales, on sait qu’une mole de gaz occupe 22,4 dm 3 . Cela permet de conclure que 67,2 dm 3 d’hydrogène réagissent avec 22,4 dm 3 d’azote pour former 44,8 dm 3 d’ammoniac. e) Une autre relation utile est la loi d’Avogadro, qui stipule que des volumes égaux de gaz différents contiennent le même nombre de particules dans les mêmes conditions de pression et de température. Connaissant la constante d’Avogadro de 6,022·10 23 , nous savons qu’il nous faut 3·6,022·10 23 molécules d’hydrogène et 6,022·10 23 molécules d’azote pour réaliser la réaction chimique complète de synthèse de l’ammoniac. La réaction donne 2,022,10 23 molécules d’ammoniac.
Exemple 2.
La réaction de combustion du magnésium dans le chlore se déroule selon l’équation : ![]() nous permet de proposer des interprétations similaires à l’exemple précédent. a) Même à première vue, l’équation présentée permet de conclure que, pour obtenir une molécule de chlorure de magnésium , nous devons fournir une molécule de magnésium et une molécule de chlore comme substrats. b) Cela équivaut bien entendu au nombre de moles présentes dans le système, soit une mole de magnésium, une mole de chlore, une mole de chlorure de magnésium. c) Pour les calculs de masse, on sait que 24 g de magnésium réagissent avec 71 g de chlore pour former 95 g de chlorure de magnésium. d) Puisqu’un seul gaz, le chlore , est impliqué dans la réaction chimique considérée, on peut aussi écrire pour lui qu’il occupe un volume de 22,4 dm 3 . e) En comptage de particules, chaque composant est égal à l’autre et prend la valeur 6,022·10 23 .
nous permet de proposer des interprétations similaires à l’exemple précédent. a) Même à première vue, l’équation présentée permet de conclure que, pour obtenir une molécule de chlorure de magnésium , nous devons fournir une molécule de magnésium et une molécule de chlore comme substrats. b) Cela équivaut bien entendu au nombre de moles présentes dans le système, soit une mole de magnésium, une mole de chlore, une mole de chlorure de magnésium. c) Pour les calculs de masse, on sait que 24 g de magnésium réagissent avec 71 g de chlore pour former 95 g de chlorure de magnésium. d) Puisqu’un seul gaz, le chlore , est impliqué dans la réaction chimique considérée, on peut aussi écrire pour lui qu’il occupe un volume de 22,4 dm 3 . e) En comptage de particules, chaque composant est égal à l’autre et prend la valeur 6,022·10 23 . 
Rendement en pourcentage de la réaction chimique [ %W]
Les calculs stœchiométriques sont également utilisés pour connaître le rendement d’une réaction, c’est-à-dire le rapport entre la quantité réelle de produit obtenue et la quantité dérivée de l’équation de la réaction chimique.
Exemple 1.
La réaction d’oxydation de 30 kg d’oxyde de soufre (IV) a été réalisée et, en présence d’un catalyseur au platine, le produit obtenu est 34 kg d’oxyde de soufre (VI). Quel a été le rendement de ce procédé ? Équation de réaction chimique : ![]() D’après la réaction enregistrée, nous pouvons voir que deux moles d’oxyde de soufre (IV) produisent la même quantité de moles d’oxyde de soufre (VI). Connaissant les masses molaires des réactifs, nous savons que stœchiométriquement, en supposant un rendement de 100 %, 128 g de SO 2 produisent 160 g de SO 3 . Avec cette connaissance, nous pouvons établir le rapport : 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3. De là, nous découvrirons la quantité d’oxyde de soufre (VI) qui serait produite à 100 %rendement.
D’après la réaction enregistrée, nous pouvons voir que deux moles d’oxyde de soufre (IV) produisent la même quantité de moles d’oxyde de soufre (VI). Connaissant les masses molaires des réactifs, nous savons que stœchiométriquement, en supposant un rendement de 100 %, 128 g de SO 2 produisent 160 g de SO 3 . Avec cette connaissance, nous pouvons établir le rapport : 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3. De là, nous découvrirons la quantité d’oxyde de soufre (VI) qui serait produite à 100 %rendement. 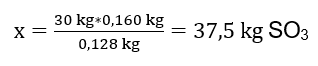 Connaissant la quantité théorique et réelle de SO 3 , nous pouvons calculer le rendement avec lequel la réaction s’est produite. 37,5 kg SO 3 – rendement 100 %34 kg SO 3 – rendement x %
Connaissant la quantité théorique et réelle de SO 3 , nous pouvons calculer le rendement avec lequel la réaction s’est produite. 37,5 kg SO 3 – rendement 100 %34 kg SO 3 – rendement x %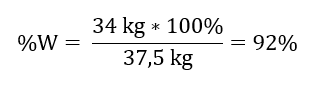 L’oxydation de l’oxyde de soufre (IV) en oxyde de soufre (VI) à l’aide d’un catalyseur au platine s’est produite avec un rendement de 92 %.
L’oxydation de l’oxyde de soufre (IV) en oxyde de soufre (VI) à l’aide d’un catalyseur au platine s’est produite avec un rendement de 92 %.
Formules moléculaires et élémentaires
Une autre application des calculs stœchiométriques consiste à déterminer les formules de composés chimiques simples. La formule moléculaire d’un composé chimique est identique ou un multiple entier de la formule empirique. Si l’on sait que la formule générale d’un composé chimique est N x O y , les valeurs des indices stoechiométriques peuvent être calculées en divisant la masse des atomes par leurs masses atomiques. Si le poids moléculaire d’un composé chimique n’est pas connu, mais seulement sa composition en pourcentage, seule la formule élémentaire peut être donnée. Il peut s’agir d’une véritable représentation de la formule moléculaire ou simplement de déterminer le rapport des éléments individuels.
Exemple 1.
Le poids moléculaire du composé chimique est de 92 u et il est composé de 30,43 %d’azote et de 69,57 %d’oxygène. Quelle est la formule moléculaire du composé chimique ? Puisque la somme des molécules présentes dans le composé est de 100 %, nous pouvons supposer que : 92 u – 100 %Cela nous permet de calculer les teneurs élémentaires individuelles : 92 u – 100 %xu d’azote – 30,43 %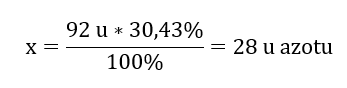 Nous savons donc que la masse par atome d’oxygène est : 92 u – 28 u = 64 u Connaissant les masses individuelles des éléments, nous pouvons déterminer les indices stoechiométriques :
Nous savons donc que la masse par atome d’oxygène est : 92 u – 28 u = 64 u Connaissant les masses individuelles des éléments, nous pouvons déterminer les indices stoechiométriques : 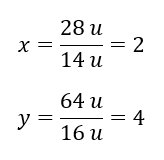 La formule moléculaire de ce composé chimique est N 2 O 4 .
La formule moléculaire de ce composé chimique est N 2 O 4 .
Exemple 2.
Il y a deux éléments dans le composé chimique : l’oxygène à 60 %et 40 %de soufre. Quelle est sa formule élémentaire ? La formule générale est S x O y , où x vaut 40 %et y vaut 60 %. Connaissant les masses molaires des éléments individuels, cela peut être représenté comme suit : 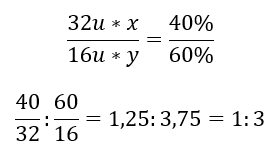 Cela signifie que dans un composé chimique donné, il y a trois atomes d’oxygène pour chaque atome de soufre. La formule élémentaire est SO 3 .
Cela signifie que dans un composé chimique donné, il y a trois atomes d’oxygène pour chaque atome de soufre. La formule élémentaire est SO 3 . 
Substrat excédentaire et limitant
Dans le cas de réactions dans lesquelles les réactifs sont présents dans des rapports divergents de leur stœchiométrie correspondante, l’un des réactifs réagira complètement et la réaction s’arrêtera. Il est alors présent sous la forme du réactif limitant, tandis que le deuxième réactif sera dans le système en excès et sera également toujours présent dans le système sous sa forme primaire une fois la réaction terminée.
Exemple 1.
Au laboratoire, 40 cm 3 d’une solution de sulfate d’aluminium 0,25 M ont été mis à réagir avec 50 cm 3 d’une solution de chlorure de baryum 0,5 M. Combien de grammes de précipité seront formés ? Équation de réaction chimique : ![]() La première étape pour connaître le déroulement réel d’une réaction consiste à déterminer le nombre réel de moles des substances impliquées dans la réaction. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol La deuxième étape est déterminer le substrat déficitaire sur la base de la stœchiométrie de la réaction – cela déterminera la quantité de précipité formé. 1 mole d’Al 2 (SO 4 ) 3 – 3 mole de BaCl 2 0,010 mole d’Al 2 (SO 4 ) 3 – x mole de BaCl 2
La première étape pour connaître le déroulement réel d’une réaction consiste à déterminer le nombre réel de moles des substances impliquées dans la réaction. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol La deuxième étape est déterminer le substrat déficitaire sur la base de la stœchiométrie de la réaction – cela déterminera la quantité de précipité formé. 1 mole d’Al 2 (SO 4 ) 3 – 3 mole de BaCl 2 0,010 mole d’Al 2 (SO 4 ) 3 – x mole de BaCl 2 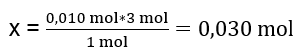 Afin de réaliser complètement la réaction, avec 0,010 mol d’Al 2 (SO 4 ) 3 , il est nécessaire d’ajouter 0,030 mol de BaCl 2 au système. Cependant, seulement 0,025mol de chlorure de baryum réagit, ce qui signifie qu’il est en déficit et limitera la réaction. Par conséquent, la quantité de précipité formé lors de la réaction doit être calculée à partir de la quantité de ce substrat. Le nombre de moles de chlorure de baryum utilisé selon la stoechiométrie de la réaction est égal au nombre de moles du précipité formé soit : n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Connaissant le nombre de moles de baryum sulfate, nous pouvons calculer sa masse : m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Les réactions et les quantités de substrats données dans la tâche produisent 5,835 g de précipité de sulfate de baryum.
Afin de réaliser complètement la réaction, avec 0,010 mol d’Al 2 (SO 4 ) 3 , il est nécessaire d’ajouter 0,030 mol de BaCl 2 au système. Cependant, seulement 0,025mol de chlorure de baryum réagit, ce qui signifie qu’il est en déficit et limitera la réaction. Par conséquent, la quantité de précipité formé lors de la réaction doit être calculée à partir de la quantité de ce substrat. Le nombre de moles de chlorure de baryum utilisé selon la stoechiométrie de la réaction est égal au nombre de moles du précipité formé soit : n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Connaissant le nombre de moles de baryum sulfate, nous pouvons calculer sa masse : m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Les réactions et les quantités de substrats données dans la tâche produisent 5,835 g de précipité de sulfate de baryum.
