Le terme "tampons de pH" fait référence à de telles solutions aqueuses qui ne changent pas leur valeur de pH malgré l'introduction d'une petite quantité de bases ou d'acides, ou pendant la dilution. Concrètement, ce sont des mélanges de solutions d'acides faibles et de leurs sels avec des bases fortes concentrées (donneur de protons – accepteur de protons) ou, de manière analogue, des mélanges de solutions de bases faibles et de leurs sels avec des acides forts. L'objectif principal de l'utilisation de solutions tampons est qu'elles agissent comme des agents permettant de maintenir la valeur du pH à un niveau assez stable. Ils sont souvent utilisés dans une large gamme d'applications chimiques, par exemple dans la fabrication de colorants, pendant les processus de fermentation, ainsi que pour déterminer la valeur du pH des produits alimentaires, cosmétiques et pharmaceutiques.
L’équation de Henderson-Hasselbach
La principale dépendance de la valeur du pH du tampon sur le pK a ou le pK b utilisé pour l’acide ou la base, respectivement, ainsi que le rapport des concentrations de l’acide et de sa base conjuguée ou, de manière analogue, de la base et de son acide conjugué, est défini par l’équation de Henderson-Hasselbach. Il montre la corrélation entre la force de l’acide appliqué et la valeur du pH. Pour une réaction d’échantillon d’un tampon produit à l’aide d’un acide faible, la procédure est la suivante : HA + H 2 O ↔ H 3 O + + A – Alors que la corrélation entre [A –], c’est-à-dire la concentration molaire de la base conjuguée [mol ·dm -3], [HA], étant la concentration molaire de l’acide non dissocié et le pK a – le logarithme négatif de la constante de dissociation à l’équilibre de l’acide (K a ), exprimé avec l’équation de Henderson-Hasselbach pour une telle réaction, a la forme suivante : 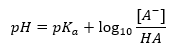
L’équation de Henderson-Hasselbach pour un tampon acétate
Le mécanisme de fonctionnement des tampons est basé sur la présence d’ions, qui sont capables de se lier aux ions hydrogène ou hydroxyde. Lorsqu’on considère un tampon acétate, qui est un mélange d’acide acétique et d’acétate de sodium, il faut noter la réaction de dissociation entre un acide acétique faible et un électrolyte fort, l’acétate de sodium (CH 3 COONa), qui est complètement dissocié en ions : CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + La solution tampon étant un mélange de ces ions, l’ajout d’une petite quantité d’un acide fort introduit [H + } }, qui sont immédiatement liés par les anions CH 3 COO – pour former de l’acide acétique non dissocié dans ces conditions. Par conséquent, cela réduit la valeur du pH. De la même manière , l’apport de cations OH supplémentaires en introduisant une base forte dans la solution n’augmentera pas le niveau de pH. Ils seront immédiatement liés par les ions H + provenant de la dissociation de l’acide acétique en molécules d’eau non dissociées. L’équation définissant la constante de dissociation acide est présentée ci-dessous : 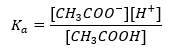 Pour la dissociation de l’acide acétique faible, la concentration totale de l’anion CH 3 COO – est définie par la concentration des ions provenant de la dissociation du sel, qui, à son tour, est la même que la concentration du sel (c s ), c’est-à-dire l’acétate de sodium. Une concentration élevée de ces anions entraîne une diminution de la concentration des cations H + et, par conséquent, le degré de dissociation acide est réduit pour maintenir la valeur de K a stable. Du fait de cette relation, on peut également supposer que le nombre de molécules CH 3 COOH non dissociées est pratiquement identique à la concentration totale en acide acétique (c k ). C’est pourquoi la constante de dissociation peut être notée comme suit :
Pour la dissociation de l’acide acétique faible, la concentration totale de l’anion CH 3 COO – est définie par la concentration des ions provenant de la dissociation du sel, qui, à son tour, est la même que la concentration du sel (c s ), c’est-à-dire l’acétate de sodium. Une concentration élevée de ces anions entraîne une diminution de la concentration des cations H + et, par conséquent, le degré de dissociation acide est réduit pour maintenir la valeur de K a stable. Du fait de cette relation, on peut également supposer que le nombre de molécules CH 3 COOH non dissociées est pratiquement identique à la concentration totale en acide acétique (c k ). C’est pourquoi la constante de dissociation peut être notée comme suit : 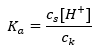 Après avoir pris le logarithme, on obtient une relation qui conduit à l’équation de Henderson-Hasselbach :
Après avoir pris le logarithme, on obtient une relation qui conduit à l’équation de Henderson-Hasselbach : 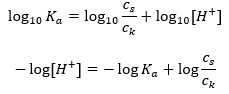 Ainsi, l’équation de Henderson-Hasselbach a la forme suivante :
Ainsi, l’équation de Henderson-Hasselbach a la forme suivante : 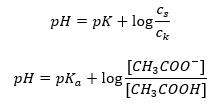 Pour écrire les relations, la valeur pKa dans l’équation est en fait la mesure de la force de l’acide. Toutes les valeurs de pKa inférieures à 3 (-log(0,001)) sont caractéristiques des acides forts, tandis que plus la valeur est élevée, plus l’acide est faible. Le fait résultant de l’équation de Henderson-Hasselbach est l’équivalence de la valeur du pH de la solution tampon et du pK a de l’acide au moment où le rapport de la concentration de l’acide non dissocié et de la concentration de l’anion produit par la dissociation de l’acide est égal à 1, car log(1) est égal à 0. De telles conditions existent à la suite du titrage d’un acide faible avec une base forte, si nous ajoutons une quantité de base qui correspond à la moitié de la quantité requise pour la neutralisation complète de l’acide. Ensuite, le degré de titrage de la solution est de 50 %. Dans la dépendance entre le pH et le volume de titrant utilisé, la valeur du pH dans la zone tampon change relativement lentement.
Pour écrire les relations, la valeur pKa dans l’équation est en fait la mesure de la force de l’acide. Toutes les valeurs de pKa inférieures à 3 (-log(0,001)) sont caractéristiques des acides forts, tandis que plus la valeur est élevée, plus l’acide est faible. Le fait résultant de l’équation de Henderson-Hasselbach est l’équivalence de la valeur du pH de la solution tampon et du pK a de l’acide au moment où le rapport de la concentration de l’acide non dissocié et de la concentration de l’anion produit par la dissociation de l’acide est égal à 1, car log(1) est égal à 0. De telles conditions existent à la suite du titrage d’un acide faible avec une base forte, si nous ajoutons une quantité de base qui correspond à la moitié de la quantité requise pour la neutralisation complète de l’acide. Ensuite, le degré de titrage de la solution est de 50 %. Dans la dépendance entre le pH et le volume de titrant utilisé, la valeur du pH dans la zone tampon change relativement lentement. 
Exemple : tampon d’ammonium
Un autre type de tampon est le tampon ammonium, qui est un mélange d’une base faible (NH 4 OH) avec un acide fort (NH 4 Cl). Cependant, le mécanisme est très similaire. Le sel présent dans le mélange subit une dissociation complète, et sa constante est l’équation suivante : 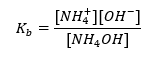 Alors que la base ammonium est pratiquement non dissociée dans l’électrolyte fort (NH 4 Cl). Pour cette raison, nous supposons que la concentration du cation NH 4 + est égale à la concentration du sel, mais la concentration des molécules NH 4 OH non dissociées est identique à la concentration de la base. Cela permet de formuler l’équation et de calculer le pH de ce tampon.
Alors que la base ammonium est pratiquement non dissociée dans l’électrolyte fort (NH 4 Cl). Pour cette raison, nous supposons que la concentration du cation NH 4 + est égale à la concentration du sel, mais la concentration des molécules NH 4 OH non dissociées est identique à la concentration de la base. Cela permet de formuler l’équation et de calculer le pH de ce tampon. 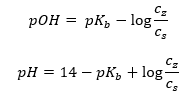 Les ions NH 4 + et Cl – et les molécules NH 4 OH présentes dans le tampon d’ammonium font qu’une fois que l’on ajoute un acide ou une base, les réactions suivantes se produisent : NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Si l’addition est faible, la modification du rapport de concentration base-sel, et donc la modification du pH, est également faible. En cas de variation décuplée du rapport de ces concentrations, la valeur du pH changera d’une unité.
Les ions NH 4 + et Cl – et les molécules NH 4 OH présentes dans le tampon d’ammonium font qu’une fois que l’on ajoute un acide ou une base, les réactions suivantes se produisent : NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Si l’addition est faible, la modification du rapport de concentration base-sel, et donc la modification du pH, est également faible. En cas de variation décuplée du rapport de ces concentrations, la valeur du pH changera d’une unité.
Capacité tampon
Le terme” capacité tampon” fait référence à la capacité d’une solution tampon à maintenir une acidité approximativement constante d’une solution. Plus précisément, c’est le nombre d’équivalents-grammes d’un acide fort ou d’une base forte qui, ajouté à 1 dm 3 d’une solution tampon, modifie sa valeur de pH de un. La formule définissant le pouvoir tampon (β) inclut sa dépendance au nombre de moles d’un acide/base fort après addition à la solution tampon (Δn, [ml]) et la variation du pH observée lors de l’ajout du volume d’un acide ou d’une base forte à la solution tampon (ΔpH). ![]() C’est une valeur qui est fortement liée aux concentrations des ingrédients, qui augmentent à mesure qu’elles augmentent. La valeur la plus élevée du pouvoir tampon caractérise les solutions tampons dont le pH est égal à la constante de dissociation (pK a ) de l’acide utilisé pour les produire.
C’est une valeur qui est fortement liée aux concentrations des ingrédients, qui augmentent à mesure qu’elles augmentent. La valeur la plus élevée du pouvoir tampon caractérise les solutions tampons dont le pH est égal à la constante de dissociation (pK a ) de l’acide utilisé pour les produire.
Principe de fonctionnement d’un tampon phosphate
Un type de tampons moins populaire sont les tampons qui contiennent deux sels acides. Dans ce cas, il s’agit de deux sels acides de l’acide orthophosphorique (V), à savoir le phosphate de sodium monobasique (V) et le phosphate de sodium dibasique (V). Contrairement aux tampons les plus courants, qui sont également basés sur le principe de Brønsted des paires acide-base conjuguées, la nature des ingrédients n’est pas si facile à déterminer. Comme les anions présents dans le tampon phosphate présentent des valeurs caractéristiques des acides de Brønsted, nous devrions vérifier plus attentivement la différence entre eux. Selon ce principe, l’ion étant l’acide le plus fort doit avoir une constante de dissociation plus élevée.
- Pour H 2 PO 4 – K a = 6,34·10 -8
- Pour HPO 4 -2 K a = 4,36·10 -13
Si nous disposons de telles données, nous pouvons facilement affirmer que dans ce cas c’est l’anion hydrogène H 2 PO 4 -13 qui est l’acide de Brønsted faible. Le mécanisme de fonctionnement du buffer est basé sur un équilibre dynamique qui peut être exprimé par l’équation suivante : ![]() Si nous ajoutons de petites quantités d’acide à la solution tampon, le système essaiera d’empêcher les changements de pH dus à la réaction de blocage de l’effet des cations [H +] en protonant l’anion hydrogène, selon ce qui suit équation:
Si nous ajoutons de petites quantités d’acide à la solution tampon, le système essaiera d’empêcher les changements de pH dus à la réaction de blocage de l’effet des cations [H +] en protonant l’anion hydrogène, selon ce qui suit équation: ![]() Le fait que ce soit l’anion qui neutralisera les tampons ajoutés à la solution est une conséquence du fait que c’est cet anion qui est la base de Brønsted la plus forte. Dans de tels systèmes, nous appliquons une règle indiquant que plus l’acide de Brønsted est fort, plus sa base conjuguée est faible. Si on ajoute un acide à un système contenant plusieurs bases de Brønsted, alors la base la plus forte sera la première à réagir. Cette relation est le composant le plus important lors de l’analyse des équilibres existant dans des mélanges de solutions tampons aqueuses constitués d’un mélange d’acides de Brønsted et d’un mélange de bases faibles de Brønsted. La même règle, mais dans l’ordre inverse, s’applique lorsque l’on ajoute une solution basique dans un tampon phosphate. Les anions OH – seront presque immédiatement capturés par l’acide de Brønsted plus fort présent dans le tampon. Dans ce cas, ce sera l’ion, et la réaction se déroulera selon l’équation suivante :
Le fait que ce soit l’anion qui neutralisera les tampons ajoutés à la solution est une conséquence du fait que c’est cet anion qui est la base de Brønsted la plus forte. Dans de tels systèmes, nous appliquons une règle indiquant que plus l’acide de Brønsted est fort, plus sa base conjuguée est faible. Si on ajoute un acide à un système contenant plusieurs bases de Brønsted, alors la base la plus forte sera la première à réagir. Cette relation est le composant le plus important lors de l’analyse des équilibres existant dans des mélanges de solutions tampons aqueuses constitués d’un mélange d’acides de Brønsted et d’un mélange de bases faibles de Brønsted. La même règle, mais dans l’ordre inverse, s’applique lorsque l’on ajoute une solution basique dans un tampon phosphate. Les anions OH – seront presque immédiatement capturés par l’acide de Brønsted plus fort présent dans le tampon. Dans ce cas, ce sera l’ion, et la réaction se déroulera selon l’équation suivante : ![]()
Tampons connus et leurs applications
- Le sang maintient les valeurs de 7,35 et 7,45 unités, et sa stabilité est garantie par la présence d’acide carbonique, principalement sous forme de dioxyde de carbone dissous et de HCO 3- C’est un tampon étant un acide faible et son sel, et tout ajout de une quantité excessive d’acides ou de bases entraînera des conditions dangereuses pour la vie humaine. Un exemple similaire de tampon est la salive, dont le pH est d’environ 7.
- Tampons ammonium, acétate, phosphate et borate, donc respectivement :
- NH3 + NH4Cl pH = 8 – 11 ;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K2HP04 + KH2PO4 pH = 5,5 – 8 ;
- H3BO3 + Na2B4O7 pH = 7 – 9 .
Tous les tampons populaires sont appliqués là où il est essentiel de maintenir le pH à un niveau constant, par exemple :
- en médecine, où ils sont administrés par voie intraveineuse à des patients dans un état critique ;
- dans les cultures microbiennes, où la réaction du sol est un facteur important ;
- en travaillant avec des enzymes et des protéines, pour stabiliser l’environnement des réactions chimiques;
- en galvanoplastie, où ils sont utilisés pour les bains électrolytiques, car ils permettent d’éviter les changements rapides et critiques de leur pH dans la zone proche de l’électrode ;
- pour l’étalonnage des pH-mètres.
