Osservando la loro struttura, gli acidi carbossilici sono importanti composti organici e sono derivati acilici. Sono una sorta di materiali da costruzione per molti derivati, inclusi esteri e ammidi. In natura possiamo trovare un'intera gamma di vari acidi carbossilici, come l'acido acetico CH 3 COOH, che è il composto base dell'aceto da tavola, l'acido butirrico CH 3 CH 2 CH 2 COOH responsabile dell'odore del burro rancido, o ancora acido colico complesso, che è il componente base dei succhi biliari umani.

La formula generale degli acidi carbossilici è:
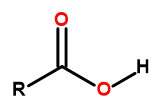
Figura 1 La formula generale degli acidi carbossilici è:
Nomenclatura degli acidi carbossilici
Secondo il sistema di nomenclatura IUPAC, gli acidi carbossilici possono essere denominati in due modi, a seconda delle dimensioni e della complessità della molecola. Gli acidi che sono derivati alifatici sono nominati sistematicamente cambiando la fine dell’alcano da -ano a -oico e aggiungendo la parola iniziale "acido", ad esempio acido propanoico, acido butanoico, acido 3-etil-6-metilottandioico. La numerazione degli atomi di carbonio in tali composti chimici inizia sempre con l’atomo nel gruppo funzionale –COOH. Il secondo sistema di denominazione, particolarmente utile per gli acidi in cui il gruppo carbossilico è attaccato all’anello, consente di aggiungere le parole "acido" prima e "carbossilico" dopo al nome sistematico del composto. In tali casi, la numerazione degli atomi di carbonio inizia con l’atomo a cui è legato il gruppo carbossilico, che a sua volta viene trattato come un sostituente.
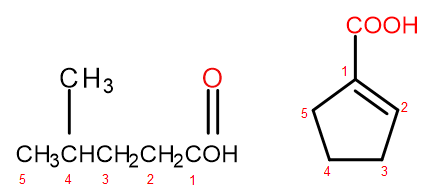
Figura 2 Numerazione degli atomi di carbonio in, da sinistra a destra: acido 4-metilpentanoico, acido 1-ciclopentenecarbossilico.
| Acido carbossilico | Gruppo acilico | ||
| Struttura | Nome | Struttura | Nome |
| HCOOH | Formico | HCO- | Formil- |
| CH 3 COOH | Acetico | CH 3 CO- | Acetil- |
| CH 3 CH 2 CH 2 COOH | Butirrico | CH 3 CH 2 CH 2 CO- | butirrile- |
| HOOOOCCOOH | ossalico | -OCCO- | Oxalil- |
| HOOC(CH 2 ) 2 COOH | Succinico | -OC (CH2) 2CO- | succinile- |
La struttura e le proprietà fisiche degli acidi carbossilici
La somiglianza del gruppo carbossilico sia con chetoni che con alcoli può suggerire proprietà fisiche simili. Come nei chetoni, l’atomo di carbonio del gruppo funzionale ha un’ibridazione sp2. Ciò è direttamente correlato alla sua struttura piatta e agli angoli di circa 120 ° tra i legami CCO e OCO. Ad esempio, l’acido acetico CH 3 COOH ha angoli di legame pari a:
- 119 o per CC=O,
- 119 o per CC-OH,
- 122° per O =C-OH.
Le lunghezze dei legami sono le seguenti:
- 52Å per CC,
- 25Å per C=O,
- 31Å per C-OH.
Gli acidi carbossilici mostrano la loro somiglianza con gli alcoli a causa della loro forte associatività causata dalla possibilità di formare legami idrogeno. In pratica, la maggior parte di questi composti esiste come dimeri ciclici la cui struttura è mantenuta dalla formazione di legami idrogeno. Un sistema così specifico di legami idrogeno influisce anche sui punti di ebollizione degli acidi carbossilici. Provoca il loro aumento significativo rispetto ai corrispondenti alcoli. Ad esempio, le costanti fisiche – il punto di fusione e il punto di ebollizione in gradi Celsius sono rispettivamente:
- Acido formico : 8,4; 100,7,
- Acido acetico: 16,6; 117,9,
- Acido propanoico: -20,8; 141,
- Acido benzoico: 122,1; 249.
Dissociazione degli acidi carbossilici
Le proprietà acide di questo gruppo di composti consentono loro di reagire con basi, tra cui idrossido di sodio e bicarbonato di potassio. I prodotti di tali reazioni sono sali di acidi carbossilici. La solubilità degli acidi carbossilici in acqua è trascurabile, ma i loro sali con metalli alcalini, a causa della loro struttura ionica, si sciolgono molto bene in acqua. Questi composti, che sono acidi nella teoria di Bronsted-Lowry, si dissociano in soluzioni acquose diluite. Come risultato della trasformazione si formano l’anione carbossilato RCOO – e il catione idronio H 3 O + .
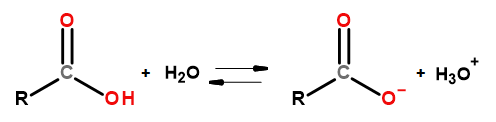
Figura 3Schema di dissociazione dell’acido carbossilico.
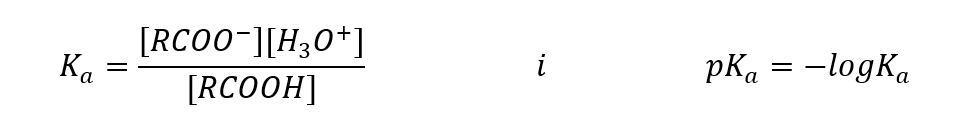 I valori empiricamente determinati per gli acidi carbossilici mostrano che sono composti debolmente dissociati, quindi in pratica sono anche acidi deboli. Per la maggior parte di essi, la costante K a assume un valore di circa 10 -5 . Per l’acido acetico K a = 1,76·10 -5 , che, dopo conversione, dà al pK un valore pari a 4,75. Ciò equivale alla dissociazione di solo lo 0,1%circa delle molecole, che, rispetto agli acidi inorganici forti con un grado di dissociazione del 100%, conferma che si tratta di acidi a bassa resistenza. Rispetto agli alcoli, le cui costanti di equilibrio oscillano nell’ordine di grandezza 10-16 , gli acidi carbossilici sono molto più forti. Nonostante la loro somiglianza strutturale, questo fatto è dovuto alla stabilità dell’anione carbossilato rispetto all’anione alcossido. Si noti che la carica negativa negli alcossidi è su un singolo atomo di ossigeno, che è altamente elettronegativo. Al contrario, negli anioni carbossilato, la carica è delocalizzata tra i due ossigeni del gruppo funzionale. Questo lo rende più stabile rispetto all’anione prodotto dagli alcoli.
I valori empiricamente determinati per gli acidi carbossilici mostrano che sono composti debolmente dissociati, quindi in pratica sono anche acidi deboli. Per la maggior parte di essi, la costante K a assume un valore di circa 10 -5 . Per l’acido acetico K a = 1,76·10 -5 , che, dopo conversione, dà al pK un valore pari a 4,75. Ciò equivale alla dissociazione di solo lo 0,1%circa delle molecole, che, rispetto agli acidi inorganici forti con un grado di dissociazione del 100%, conferma che si tratta di acidi a bassa resistenza. Rispetto agli alcoli, le cui costanti di equilibrio oscillano nell’ordine di grandezza 10-16 , gli acidi carbossilici sono molto più forti. Nonostante la loro somiglianza strutturale, questo fatto è dovuto alla stabilità dell’anione carbossilato rispetto all’anione alcossido. Si noti che la carica negativa negli alcossidi è su un singolo atomo di ossigeno, che è altamente elettronegativo. Al contrario, negli anioni carbossilato, la carica è delocalizzata tra i due ossigeni del gruppo funzionale. Questo lo rende più stabile rispetto all’anione prodotto dagli alcoli.
Ottenere acidi carbossilici
- Ossidazione di alchilbenzeni sostituiti con KMnO 4 o Na 2 Cr 2 O 7 con il prodotto sotto forma di acidi benzoici sostituiti. È possibile ossidare gruppi alchilici primari e secondari,
- Ossidazione del legame C=C in alcheni con almeno un atomo di idrogeno vinilico usando KMnO 4 ,
- Ossidazione di alcoli e aldeidi primari. Alcoli che utilizzano il reagente di Jones, aldeidi che utilizzano lo stesso reagente e ossido di argento basico,
- Idrolisi dei nitrili sotto l’influenza di soluzioni forti e calde di acidi o basi,
- La reazione dei composti di Grignard con l’anidride carbonica, con un prodotto intermedio sotto forma di carbossilato di magnesio. Il composto di transizione reagisce quindi con l’acido.
Reazioni degli acidi carbossilici
A causa della loro struttura, gli acidi carbossilici, oltre alle loro caratteristiche reazioni, subiscono anche trasformazioni simili agli alcoli e ai chetoni. Come gli alcoli, possono dissociare un protone per formare un reagente nucleofilo. Come i chetoni, sono soggetti ad attacchi da parte di altri nucleofili sull’atomo di carbonio del gruppo carbonilico. Inoltre, sono possibili la loro riduzione, sostituzione nella posizione alfa, sostituzione nucleofila del gruppo acilico e deprotonazione (dissociazione). La riduzione degli acidi carbossilici avviene con LiAlH 4 , dando il prodotto come alcol primario. A volte è necessario applicare il riscaldamento in una soluzione di tetraidrofurano per aumentare l’efficienza. Un altro metodo è una riduzione con borano in soluzione di tetraidrofurano, ottenendo anche 1 o alcoli.
























































































































