In termini di struttura chimica, gli alcani appartengono al gruppo degli idrocarburi. Questi composti contengono solo due tipi di atomi: carbonio e idrogeno. Sono composti dalla struttura di carbonio di base legata agli atomi di idrogeno. Gli alcani hanno solo legami singoli, motivo per cui sono chiamati idrocarburi saturi.

Serie omologa
Disposti dalla crescente quantità di atomi di idrogeno nella loro struttura, i rappresentanti degli alcani formano una serie omologa. Inizia con il metano, contenente un atomo di carbonio, e termina con il decano con nove atomi di carbonio. I nomi degli alcani derivano dalla quantità di atomi di carbonio presenti nella struttura e sono definiti con numeri greci o latini oltre che dalla caratteristica desinenza -ano, come con eptano, nonano, ecc. La formula generale per gli alcani è la seguente: , dove ‘n’ sta per il numero di carbonio (C) presente nella catena e ‘H’ rappresenta gli atomi di idrogeno.
| Il numero di atomi di carbonio presenti nella catena | Formula alcanica | Nome alcano |
| 1 | CAP 4 | Metano |
| 2 | C2A6 _ | Etano |
| 3 | C3A8 _ | Propano |
| 4 | C4H10 _ | Butano |
| 5 | C5H12 _ | Pentano |
| 6 | C6H14 _ | Esano |
| 7 | C7H16 _ | Eptano |
| 8 | C8H18 _ | Ottano |
| 9 | C 9 H 20 | Nonano |
| 10 | C10 H22 | Decano |
Tipi di idrocarburi saturi
In termini di struttura della catena, distinguiamo i seguenti tipi di alcani:
-
Alcani lineari (paraffinici).
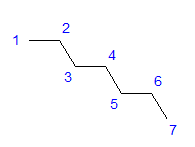 Fig. 1 Formula strutturale dell’eptano Tutti gli atomi di carbonio mostrano l’ibridazione sp 3 . A causa di un angolo tetragonale tra i legami, è necessaria una disposizione a zigzag degli atomi di carbonio. Le molecole possono assumere varie disposizioni, poiché è possibile la rotazione libera attorno a un singolo legame tra atomi di carbonio. Maggiore è il numero di carbonio nella struttura, più varie possono essere le forme della catena.
Fig. 1 Formula strutturale dell’eptano Tutti gli atomi di carbonio mostrano l’ibridazione sp 3 . A causa di un angolo tetragonale tra i legami, è necessaria una disposizione a zigzag degli atomi di carbonio. Le molecole possono assumere varie disposizioni, poiché è possibile la rotazione libera attorno a un singolo legame tra atomi di carbonio. Maggiore è il numero di carbonio nella struttura, più varie possono essere le forme della catena.
-
Isoalcani: idrocarburi saturi ramificati
La formazione di idrocarburi ramificati è l’effetto del legame tra un atomo di carbonio e più di altri due atomi di carbonio. Un ramo si forma nel punto di tale collegamento. Gli idrocarburi ramificati sono isomeri idrocarburici lineari. 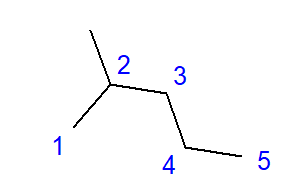 Fig. 2 Formula strutturale per il 2-metilpentano La formula per il 2-metilpentano mostrata in Fig. 2 ha un totale di sei atomi di carbonio ed è un isomero esano. Il nome "2-metilpentano" significa che la catena del pentano ha un gruppo metilico legato nella posizione del secondo atomo di carbonio. Il numero di possibili isomeri strutturali cresce insieme al crescente numero di carbonio. Per fare un esempio, l’esano può avere una struttura di 5 diversi isomeri, l’ottano ha 18 di tali possibilità e l’esano fino a 75.
Fig. 2 Formula strutturale per il 2-metilpentano La formula per il 2-metilpentano mostrata in Fig. 2 ha un totale di sei atomi di carbonio ed è un isomero esano. Il nome "2-metilpentano" significa che la catena del pentano ha un gruppo metilico legato nella posizione del secondo atomo di carbonio. Il numero di possibili isomeri strutturali cresce insieme al crescente numero di carbonio. Per fare un esempio, l’esano può avere una struttura di 5 diversi isomeri, l’ottano ha 18 di tali possibilità e l’esano fino a 75.
-
Idrocarburi ciclici: cicloalcani, idrocarburi aliciclici
È possibile chiudere la struttura della catena formando anelli composti da elementi –CH 2 ripetuti. I nomi sono basati sul nome dell’alcano con il prefisso ‘ciclo-‘, come ciclobutano o cicloeptano. Per semplificare, possono essere presentati come poligoni regolari. 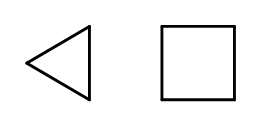 Fig. 3 Da sinistra: ciclopropano, ciclobutano Esistono anche anelli sostitutivi, i cui nomi comprendono i sostituenti. In questo caso, il numero di atomi di carbonio è progettato in modo tale che la posizione dei sostituenti sia possibilmente bassa.
Fig. 3 Da sinistra: ciclopropano, ciclobutano Esistono anche anelli sostitutivi, i cui nomi comprendono i sostituenti. In questo caso, il numero di atomi di carbonio è progettato in modo tale che la posizione dei sostituenti sia possibilmente bassa.
Rappresentanti più importanti
Il metano è un composto di formula molecolare CH 4 , che dà inizio alla serie omologa degli alcani. Il carbonio è tetravalente, quindi ha quattro legami CH. A temperatura ambiente è un gas inodore e incolore. Poiché l’atomo di carbonio mostra l’ibridazione sp 3 , è strutturato come tetraedro e gli orbitali prodotti formano legami equivalenti insieme a quattro atomi di idrogeno. L’etano è il prossimo alcano della serie, la cui formula molecolare è C 2 H 6 . Osservando la formula semi-strutturale H 3 C-CH 3 , noteremo che ogni atomo di carbonio è legato a tre atomi di idrogeno. Proprio come il metano e altri idrocarburi inferiori, è un gas incolore e inodore. I legami CH sono legami sigma sp-s frontali, mentre un singolo legame tra atomi di carbonio è un legame sigma sp-sp frontale.
La sintesi degli alcani
- L’idrogenazione di alcheni o alchini

- L’idrolisi dei composti di Grignard
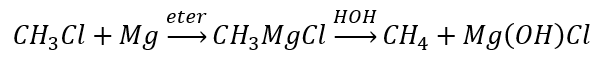
- La riduzione degli alogenuri alchilici
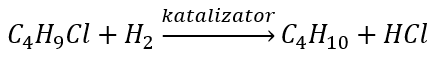
- Reazione di Wurtz
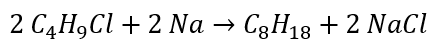
La riduzione di aldeidi e chetoni
- Riduzione di Clemmensen
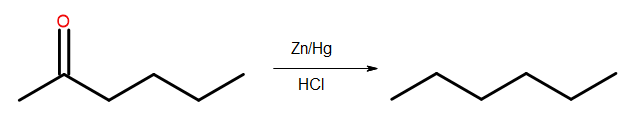 Fig. 4 Diagramma della riduzione di Clemmensen
Fig. 4 Diagramma della riduzione di Clemmensen
- Reazione di Wolff-Kishner
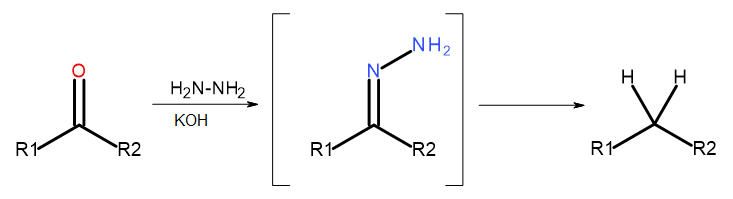 Fig. 5 Schema di Wolff-Kishner
Fig. 5 Schema di Wolff-Kishner
Le proprietà fisico-chimiche degli alcani
Gli alcani a catena corta da C 1 a C 4 a temperatura ambiente sono gas. Altri omologhi (a partire dal pentano) sono liquidi con punto di ebollizione crescente. I rami presenti nella struttura determinano un punto di ebollizione inferiore degli isomeri. La dipendenza dell’aggiunta di un altro gruppo -CH 2 – nella struttura aumenta il punto di ebollizione di circa 20-30 o C più in alto insieme all’aumento della lunghezza della catena di carbonio. Lo stato di aggregazione degli alcani dall’ottadecano in su è solido con punti di fusione a partire da 28 ° C per l’n-ottadecano. Gli idrocarburi solidi includono la paraffina, mentre gli idrocarburi liquidi superiori includono l’olio di paraffina. A causa della loro natura idrofobica, le molecole di alcano non si mescolano con l’acqua, non vengono bagnate dall’acqua e non si dissolvono in acqua. Tuttavia, con la loro affinità per le caratteristiche non polari, si dissolvono facilmente in se stessi e in simili solventi organici non polari, mediamente e poco polari. La solubilità degli alcani in due comuni solventi alcolici (metanolo ed etanolo) è relativamente buona. Nel metanolo, gli alcani si dissolvono bene solo fino a una concentrazione specificata. L’eccesso di tale concentrazione provoca la separazione delle fasi. Nell’etanolo, gli alcani inferiori si dissolvono molto facilmente, mentre è un po’ più difficile sciogliere gli alcani superiori. Gli idrocarburi superiori sono sostanze infiammabili. Gli idrocarburi gassosi così come le coppie di idrocarburi liquidi formano miscele con potenziale di esplosione se miscelate con l’aria. La reattività degli alcani è relativamente bassa a causa della mancanza di gruppi funzionali potenzialmente reattivi. I legami tra gli atomi di carbonio (CC) così come quelli tra gli atomi di carbonio e ossigeno (CH) sono altamente resistenti alla scissione. Le energie di questi legami sono rispettivamente di 88 kcal/mol e 104 kcal/mol. Possono reagire bruscamente solo in determinate condizioni.
Le reazioni degli alcani
- Combustione completa – con emissione di anidride carbonica
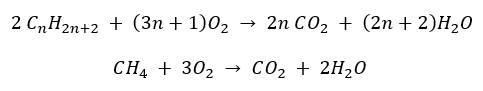
- Semicombustione – con ossigeno limitato ed emissione di monossido di carbonio
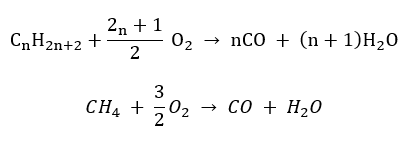
- Combustione incompleta : il nerofumo si forma con una quantità molto limitata di ossigeno
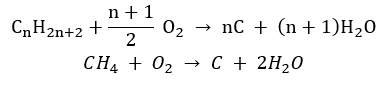
- La reazione di sostituzione (alogenazione radicale, esemplificata dalla reazione del metano con il cloro con la partecipazione della luce)
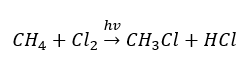
- La pirolisi è la decomposizione degli alcani in molecole più piccole ad una temperatura molto elevata. A seconda del processo, possono verificarsi fessurazioni, idrocracking o isomerizzazione.
- Nitrazione con utilizzo di acido nitrico(V) e formazione di una miscela di prodotti: isomeri con il sostituente –NO 2 in varie località.
- Solfonazione a due stadi, dove i mersoli sono prodotti intermedi e i mersolani sono il prodotto finale.






















































































































