Gli alcheni sono idrocarburi insaturi che, come gli alcani, formano una serie omologa. Tuttavia, a differenza degli alcani, gli alcheni hanno un legame multiplo - un doppio legame - tra gli atomi di carbonio. I rimanenti sono legami singoli, ma la presenza anche di un solo legame multiplo in una molecola rende l'idrocarburo un composto insaturo.

La struttura degli alcheni
Il legame CC tra gli atomi negli idrocarburi saturi fa sì che ciascuno di essi abbia un’ibridazione sp 3 . Negli alcheni, che hanno legami C=C, si verifica un’ibridazione sp2. Questa proprietà fa sì che la struttura dei composti con doppi legami sia una forma trigonale. I suoi 3 legami sigma sono sullo stesso piano e sono rivolti verso gli angoli del triangolo equilatero, il cui centro è l’atomo di carbonio. Al contrario, i legami pi derivano dalla sovrapposizione di un orbitale p non ibrido in una direzione perpendicolare al triangolo, che è formato da orbitali ibridi e orbitali di simmetria simile dell’atomo vicino. La costruzione più semplice del gruppo, e il primo composto nella serie omologa degli alcheni, è l’etene. Il metano, un composto che è il primo degli alcani, non potrebbe formare un legame multiplo.
Un esempio della struttura dell’alchene
Prendiamo il composto più semplice del gruppo, l’etene, ed esaminiamo la sua struttura. Sappiamo che gli atomi di carbonio nella molecola di etene hanno un’ibridazione sp 2 , quindi la molecola è piatta. Gli angoli tra i legami in questa disposizione sono di 120 ° . I quattro legami tra gli atomi di carbonio e idrogeno presenti nella struttura CH sono legami sigma δ SP-s con una sovrapposizione frontale. Ci sono anche legami omonucleari formati tra gli atomi di carbonio. Uno è CC δ sp-sp e l’altro è CC π pp , formato da orbitali p non ibridi.
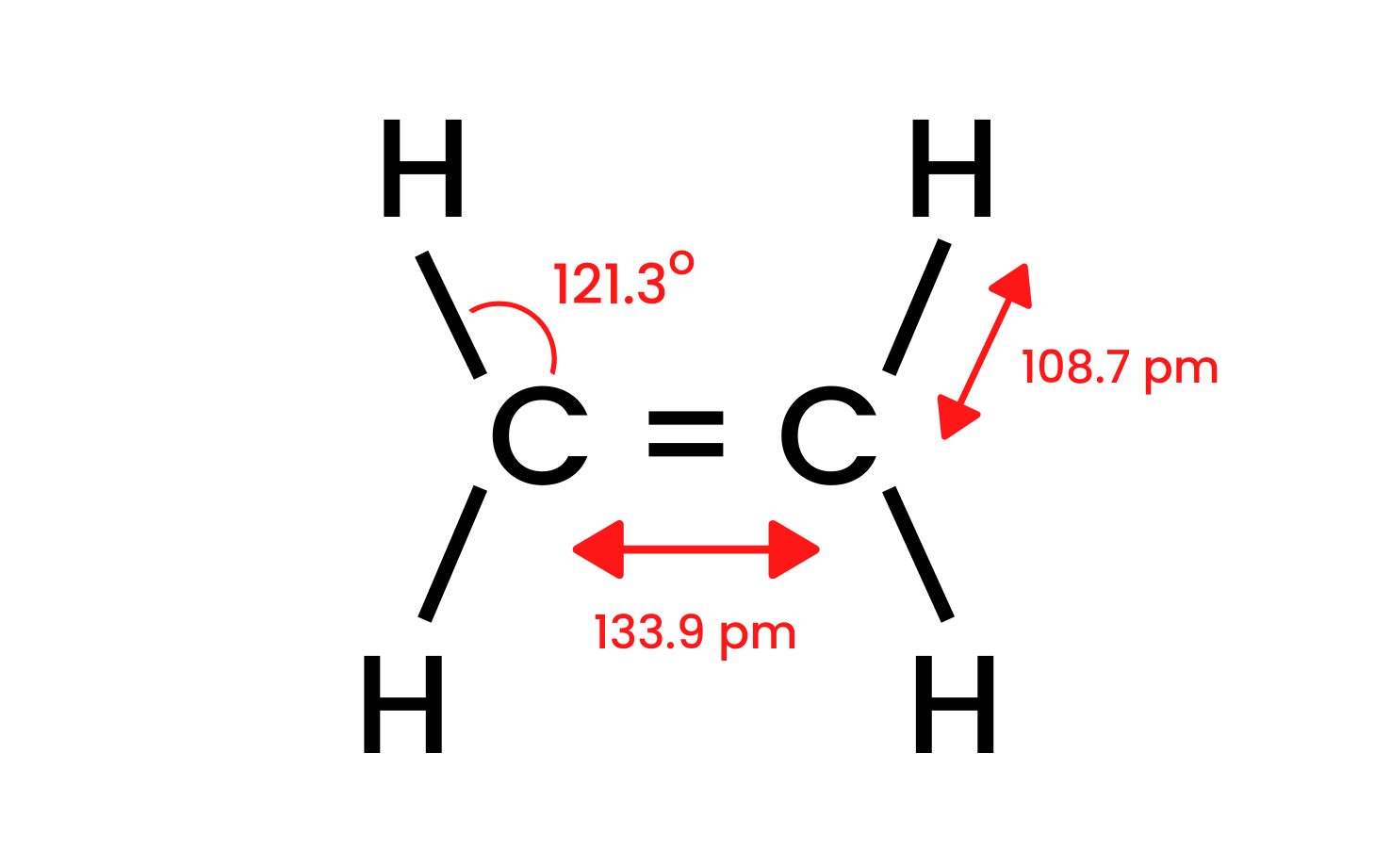
Figura 1. La struttura dell’etene
Serie omologa degli alcheni
Una serie omologa è un gruppo di composti chimici che hanno una struttura chimica e proprietà molto simili. Tali sostanze possono anche essere scritte con una formula molecolare comune. La formula generale per gli alcheni può essere scritta come C n H 2n . Strutturalmente, ha questo aspetto:
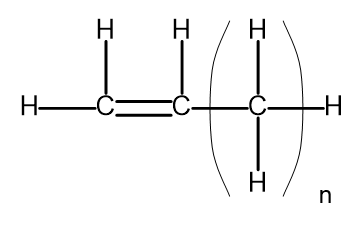
Figura 2. Formula strutturale generale per gli alcheni
| Numero di atomi di carbonio nella catena | Formula alcanica | Nome alcano | Formula alchenica | nome alchene |
| 2 | C2A6 _ | Etano | C2A4 _ | Etene |
| 3 | C3A8 _ | Propano | C3A6 _ | Propene |
| 4 | C4H10 _ | Butano | C4H8 _ | Butene |
| 5 | C5H12 _ | Pentano | C5H10 _ | Pentene |
| 6 | C6H14 _ | Esano | C6H12 _ | Esene |
| 7 | C7H16 _ | Eptano | C7H14 _ | Eptene |
| 8 | C8H18 _ | Ottano | C8H16 _ | Ottene |
| 9 | C 9 H 20 | Nonano | C 9 H 18 | Nonene |
| 10 | C10 H22 | Decano | C 10 H 20 | Decene |
I composti dal butene al decene possono avere ramificazioni in posizioni uguali di atomi di carbonio, quindi possono anche essere chiamati but-1-ene, ept-1-ene o dec-1-ene. Ciò significa che il legame insaturo è presente tra gli atomi di carbonio che danno inizio alla catena. Il fenomeno delle varie possibilità di posizionamento del legame multiplo insaturo è chiamato isomerismo posizionale. Ad esempio, un composto con la formula molecolare C 7 H 14 ha diversi possibili isomeri posizionali. Il doppio legame nella sua struttura può essere localizzato, ad esempio, in corrispondenza degli atomi di carbonio numero uno e tre, come mostrato in Figura 3.
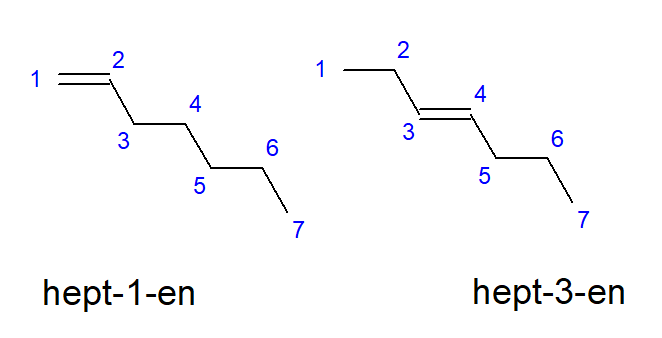
Figura 3. Formule strutturali di ept-1-ene (1-eptene) ed ept-3-ene (3-eptene)
Struttura degli alcheni – riassunto
Ogni alchene ha un doppio legame pi greco (π) in corrispondenza del quale vengono create strutture piatte. Gli atomi di carbonio hanno un’ibridazione sp 2 , caratterizzata da una forma trigonale. In luoghi saturi, i gruppi -CH 2 – metilene possono creare catene diritte e ramificate spazialmente espanse. La rotazione avviene solo attorno ai singoli legami, e non avviene nel caso del legame C=C. Le proprietà fisiche e chimiche di base del gruppo degli alcheni Gli alcheni hanno proprietà idrofobiche e quindi hanno una natura non polare. Entrano in reazione con l’acqua. A causa della loro affinità, si dissolvono bene in solventi apolari come gli alcani. Il punto di fusione, il punto di ebollizione e la densità degli alcheni aumentano all’aumentare del numero di atomi di carbonio nella molecola. La loro attività è la più grande negli alcheni a catena corta.
Ottenimento di alcheni
Esistono diversi modi per ottenere alcheni. Ognuno di questi modi si basa sull’eliminazione di due sostituenti in corrispondenza di un singolo legame, come mostrato nel diagramma:
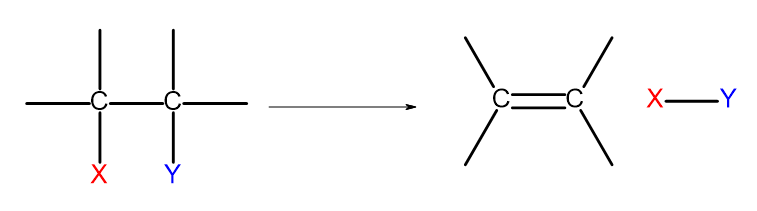
Figura 4. Il diagramma del processo di eliminazione che porta alla formazione di un alchene
Ottenimento dell’etene
1. Deidrogenazione di un alcano 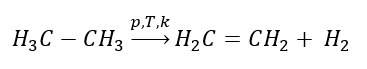 2. Disidratazione di un alcool
2. Disidratazione di un alcool 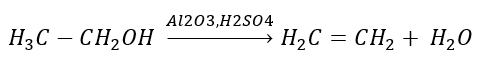 3. La reazione di un alogeno-alcano con una base forte
3. La reazione di un alogeno-alcano con una base forte 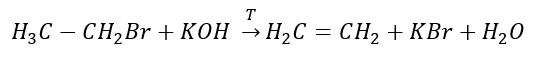 4. La reazione di un dialogano-alcano con polvere di zinco
4. La reazione di un dialogano-alcano con polvere di zinco 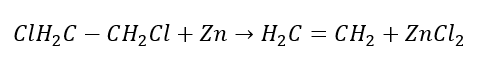 5. Idrogenazione di un alchino
5. Idrogenazione di un alchino 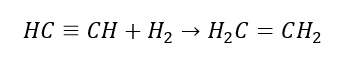
Reazioni chimiche degli alcheni
Un frammento particellare specifico, che allo stesso tempo ne definisce le proprietà e l’affiliazione, è chiamato gruppo funzionale. Per gli alcheni, questo gruppo è un doppio legame (C=C). Il legame pi (π) che contiene è molto suscettibile alla rottura. Rispetto agli elettroni dei legami sigma, gli elettroni che occupano l’orbitale pi sono più lontani dagli atomi di carbonio e quindi sono meno associati ad essi. Ciò si traduce in una loro maggiore mobilità e maggiore disponibilità per l’avvicinamento ai reagenti, con conseguente elevata reattività chimica del legame. Esistono diversi tipi di reazioni in base alle quali gli alcheni vengono trasformati. Questi sono: addizione elettrofila, addizione di radicali liberi, ossidazione e riduzione, polimerizzazione e sostituzione allilica.
Addizione elettrofila
A causa della natura degli elettroni del legame pi greco, gli agenti che li attaccano hanno un carattere elettropositivo. Tali molecole sono reagenti elettrofili che hanno un’elevata affinità per gli elettroni. Nella maggior parte dei casi, questo fattore è un protone di origine acida, un gap elettronico o una molecola che si polarizza facilmente a causa della vicinanza agli elettroni pi. L’addizione, cioè la reazione di connessione, segue il meccanismo ionico. Questo è un meccanismo in due fasi per cui un reagente elettrofilo inizialmente in avvicinamento cattura gli elettroni del legame pi greco con la creazione di un singolo legame e la formazione di un carbocatione transitorio. Questa molecola altamente reattiva attacca rapidamente altri reagenti che hanno la capacità di mettere in comune gli elettroni. Esempi di tali reazioni sono le aggiunte di cloro o bromo a un alchene. L’idrogeno può anche essere aggiunto (idrogenizzazione) per addizione, ma non è elettrofilo.
Reazioni di addizione di radicali liberi
Molte reazioni di alcheni mostrano la non conformità con la regola di Markovnikov. Il loro meccanismo si concentra sulla reazione degli elettroni del legame pi ai radicali liberi, durante la quale viene prodotto un legame particellare che attacca il carbonio. Come risultato di questi cambiamenti, si ottiene un nuovo radicale libero, che ha un elettrone spaiato nell’atomo di carbonio vicino.
Sostituzione allilica
Oltre alla reazione che coinvolge il doppio legame, gli alcheni possono anche reagire in modo simile a quello degli alcani nei gruppi alchilici vicini. Un esempio di tale reazione è la sostituzione di un atomo di idrogeno con alogeno nell’atomo vicino all’atomo di carbonio che forma il doppio legame. Questa reazione non influisce sulla parte insatura della struttura.
