Per definizione, l'attività chimica è la capacità di un elemento di donare elettroni nelle reazioni chimiche. In pratica, la loro attività aumenta al diminuire dell'elettronegatività, una misura della capacità di un elemento di attrarre elettroni. Se un metallo non attira fortemente gli elettroni, è più reattivo. Un elemento di riferimento, l'idrogeno, viene utilizzato per classificare l'attività chimica dei metalli. Una misura dell'attività di un metallo è la sua capacità di spostare l'idrogeno dagli acidi o l'idrogeno da una molecola d'acqua.

Serie di attività chimica dei metalli
Questo termine è usato per descrivere l’insieme degli elementi chimici di natura metallica , in un ordine specifico dal meno attivo al più chimicamente attivo. Viene utilizzato per confrontare l’attività di diversi metalli. Oltre ai metalli, la serie delle attività chimiche comprende anche un non metallo, l’idrogeno , che è l’elemento di riferimento. Più un metallo si trova in alto nella serie di attività, più è reattivo . È anche legato al fatto che si ossida più facilmente e quindi è un riducente più forte e un elemento chimicamente più attivo. Al contrario, più un metallo si trova in basso nella serie di attività, meno è reattivo. Ciò significa che subisce più facilmente una reazione di riduzione ed è quindi un ossidante più forte, un elemento meno attivo. Utilizzando i valori riportati nella Tabella 1, possiamo vedere che quanto più basso è il valore del potenziale standard di un elemento, tanto più forte è il riducente e più chimicamente reattivo il metallo. Una misura della capacità di donare elettroni in una serie di attività metalliche è il loro valore potenziale standard . Per l’idrogeno, o meglio per l’elettrodo a idrogeno, si presuppone che il potenziale standard sia zero. Il potenziale standard è la forza elettromotrice di una cella costituita da una semicella standard di idrogeno e da un’altra semicella in cui le concentrazioni di substrati e prodotti sono 1 mol/dm 3 .
| Elettrodo | Potenziale standard [V] |
| Li/Li + | -3.04 |
| Ca/Ca2 + | -2.86 |
| Mg/Mg 3+ | -2.36 |
| Al/Al3 + | -1,69 |
| Mn/Mn 2+ | -1.18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe2 + | -0,44 |
| Cd/Cd2 + | -0,40 |
| Co/Co2 + | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Tabella 1 . Serie elettrochimica dei metalli I metalli visibili nella parte superiore della serie sono i più attivi. Quelli al di sopra dell’idrogeno tendono ad ossidarsi facilmente e sono quindi agenti riducenti più forti dell’idrogeno. Gli elementi inferiori all’idrogeno nella serie si riducono più facilmente e sono ossidanti più forti. Se un metallo ha un potenziale più negativo di un altro, significa che lo sposterà dal suo sale. Ad esempio, il ferro sostituirà il rame nei sali di rame, ma il rame non sostituirà il ferro dai suoi sali. Invece, può spostare l’argento dai sali d’argento. Il litio e il berillio provenienti da soluzioni di sali di altri metalli non li spostano, ma reagiscono direttamente con l’acqua. Sostituiscono l’idrogeno e producono i loro composti: gli idrossidi . Tali metalli sono chiamati metalli attivi. Attività dei metalli e tavola periodica degli elementi Come molte altre proprietà, l’attività chimica di un elemento può essere dedotta dalla sua posizione nella tavola periodica . I metalli più attivi sono quelli dei gruppi I e II, poiché sostituiscono facilmente l’idrogeno dall’acqua per formare idrossidi. Nel gruppo, l’attività chimica dei metalli aumenta con l’aumentare del numero atomico . Il periodo diminuisce all’aumentare del numero atomico. 
Metalli preziosi e vili
L’idrogeno non solo fornisce un punto di riferimento dell’attività, ma separa anche i metalli preziosi e quelli di base nella serie . I metalli di base sono quelli al di sopra dell’idrogeno. Ciascuno reagisce con gli acidi, spostando da essi l’idrogeno. Dal potassio al calcio reagiscono con l’acqua già a temperatura ambiente e dal magnesio al ferro reagiscono con essa a temperature elevate. Tutti i metalli che sono al di sotto dell’idrogeno nella serie di attività non spostano l’idrogeno dagli acidi . Possono però reagire con acidi ossidanti per formare i corrispondenti sali e ossidi , che si formano riducendo il residuo acido. Gli elementi alla base della serie, dall’argento all’oro, sono così resistenti alle reazioni chimiche che reagiscono solo con l’acqua regia . Tale soluzione è una miscela di una soluzione concentrata di acido cloridrico e una soluzione concentrata di acido nitrico (V) , miscelate in un rapporto volumetrico di 3:1. Conoscendo questi fatti si può dedurre che si possono effettuare diverse reazioni per distinguere l’attività dell’elemento: con acqua a temperatura ambiente, con acqua calda, con acido non ossidante, con acido ossidante e con acqua regia.
Esperimento per rilevare i metalli che sostituiscono l’idrogeno dagli acidi
Il modo più semplice per confermare l’attività del metallo è condurre un esperimento. Per fare questo si dovranno preparare dieci provette nelle quali verranno posti successivamente: in 1-5: nastro di magnesio, filo di zinco, filo di ferro, filo di nichel e filo di rame. Lo stesso ordine dovrebbe essere ripetuto nelle provette 6-10. Aggiungere alcuni millilitri di acido cloridrico ai tubi 1-5 e alcuni millilitri di acido solforico diluito (VI) ai tubi 6-10. Applicare una stecca accesa su ciascun tubo. Nelle provette che contengono nastri di magnesio e fili di ferro, zinco e nichel, inondate di acidi, vengono emesse bolle di gas. Il rilascio più intenso può essere osservato nei tubi contenenti magnesio. Le reazioni che avvengono sono le seguenti: 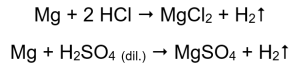 La quantità di gas emesso diminuisce nella serie: zinco, ferro, nichel. Di conseguenza si verificano le seguenti reazioni:
La quantità di gas emesso diminuisce nella serie: zinco, ferro, nichel. Di conseguenza si verificano le seguenti reazioni:  Nei tubi che contenevano fili di rame non è visibile alcun gas, nessun cambiamento. Ciò significa che tali reazioni non si verificano:
Nei tubi che contenevano fili di rame non è visibile alcun gas, nessun cambiamento. Ciò significa che tali reazioni non si verificano: 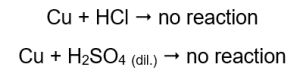 Quando viene applicata una stecca accesa, si sente un suono caratteristico nei tubi da cui viene emesso il gas.
Quando viene applicata una stecca accesa, si sente un suono caratteristico nei tubi da cui viene emesso il gas.
Sintesi delle osservazioni e conclusioni:
Magnesio, zinco, ferro e nichel reagiscono sia con l’acido cloridrico che con l’acido solforico (VI). Ciascuno sposta l’idrogeno dall’acido, il che significa che sono più in alto nella serie di attività del metallo rispetto all’acido. Le reazioni producono prodotti sotto forma di sali e di un gas, l’idrogeno, che viene rilasciato. Il suono caratteristico che accompagnava l’applicazione di una stecca luminosa a una provetta piena di gas è causato dalla reazione dell’idrogeno con l’ossigeno. Di tutti i metalli testati, il magnesio è il più reattivo, seguito da zinco, ferro, nichel e rame. Possiamo dirlo perché l’intensità delle bolle di gas indica l’attività del metallo. Non sono stati osservati cambiamenti nei tubi che contenevano rame. Ciò dimostra che il rame non è in grado di sostituire l’idrogeno né dall’acido cloridrico né dall’acido solforico diluito (VI).
