L'elettronegatività è una quantità che riflette la tendenza di un dato atomo all'interno di una molecola ad attrarre verso di sé gli elettroni. In pratica è la capacità di un atomo o di gruppi funzionali di attrarre la densità elettronica. La scala più utilizzata associata a questa grandezza è quella introdotta da Linus Pauling, che permette di calcolare facilmente, in modo approssimativo, la natura del legame.

Caratteristiche di elettronegatività
Le molecole omonucleari, ad esempio H 2 e O 2 , hanno coefficienti uguali c A e c B nei loro orbitali molecolari, che possono essere registrati come funzioni d’onda: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B In questo caso l’orbitale è caratterizzato dal fatto che la sua forma è simmetrica rispetto al centro della molecola, e la sua carica elettrica è distribuita ugualmente simmetricamente al suo interno. Tuttavia, un altro esempio sono le molecole eteronucleari, nelle quali è praticamente impossibile mantenere gli stessi coefficienti, così come la piena simmetria rispetto al centro della molecola. Quando il livello energetico dell’orbitale atomico Ψ B è inferiore al livello energetico dell’orbitale atomico Ψ A , si verifica la relazione e il massimo della densità di probabilità elettronica viene spostato verso l’atomo B. In pratica, ciò si traduce in uno spostamento dell’elettrone coppia nel legame chimico, cioè polarizzazione verso l’atomo B. Ad esempio, nella molecola di idruro di litio LiH questo spostamento avviene verso l’atomo di idrogeno, mentre nella molecola di fluoruro di idrogeno HF avviene verso l’atomo di fluoro. Ciò significa che l’atomo di idrogeno ha un livello energetico inferiore a quello del litio, ma un livello energetico superiore a quello del fluoro (leggi sugli alogeni ). In queste condizioni, uno degli atomi di entrambe le molecole assume una carica negativa denominata -δ e l’altro è positiva +δ. La formula generale di tale molecola è A +δ B -δ .
Cariche degli atomi
La suddetta carica δ può assumere valori diversi a seconda degli elementi legati dal legame chimico . Il suo valore pari a 0 significa che la carica della coppia di elettroni è distribuita simmetricamente e la coppia si trova completamente in prossimità dell’atomo con un livello energetico inferiore, con conseguente trasferimento di entrambi gli elettroni a quell’atomo. Questo crea un legame ionico tra gli elementi. Nella stragrande maggioranza dei legami chimici, tuttavia, sono presenti cariche frazionarie, che danno luogo a uno stato intermedio tra legame covalente e ionico.
Momento dipolare
Un dipolo è una molecola in cui si possono distinguere due poli: positivo e negativo. Il momento di dipolo, indicato con μ, è una misura dell’entità dello spostamento di carica elettrica in esso. È definita come il prodotto del valore assoluto della carica elettrica (δ) contenuta in uno dei poli e la distanza da questi poli (l): μ = δ · l Una carica positiva (δ+) e una carica negativa ( δ-) è chiamata carica parziale e la sua posizione è attribuita a un particolare atomo, ma in realtà è solo la maggiore o minore probabilità che un elettrone sia presente attorno ai loro nuclei. Tale fenomeno viene talvolta confuso con i processi di ossidazione e riduzione , ma a differenza dei cambiamenti che avvengono in essi, tali cariche assunte dagli atomi non li fanno passare ad un altro stato di ossidazione, quindi non c’è scambio di elettroni tra loro. L’unità SI per esprimere il momento di dipolo è il metro di Coulomb (C·m). Tuttavia, nei calcoli viene utilizzata più comunemente l’unità scritta nel sistema CGS, il debye (D). Un debito corrisponde ad un valore di 3.33564·10 -30 C·m. Il più grande momento di dipolo teoricamente possibile caratterizza le molecole con un legame puramente ionico. Il più piccolo si verifica invece nelle molecole il cui legame è puramente covalente: in questo caso il momento dipolare è zero. Tuttavia, la maggior parte sono casi intermedi con caratteri particellari variabili.
Momento di dipolo dell’alogeno
Diverse relazioni tra elettronegatività e momento dipolare possono essere facilmente osservate su specifici composti chimici. Tabella 1 Momenti di dipolo degli alogenuri di idrogeno
| Composto | Momento di dipolo determinato sperimentalmente [ μ, D] | Lunghezza legame [pm] | Prodotto tra carica elementare e lunghezza del dipolo [e ·l, D] | Quota di carattere ionico [ %] | Differenza nell’elettronegatività dell’alogeno e dell’idrogeno |
| HF | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0.9 |
| HBr | 0,79 | 143 | 6.87 | 12 | 0,7 |
| CIAO | 0,38 | 162 | 7.78 | 5 | 0.4 |
Il rapporto μ/(e·l’), cioè il momento di dipolo effettivo rispetto al momento di dipolo che corrisponde a un legame ionico, può fornire una misura delle deviazioni dal legame completamente covalente. Il prodotto di questa relazione sotto forma di (μ/(e·l’))·100%rappresenta la percentuale del carattere ionico nel legame. Questo è solo un valore approssimativo, poiché il momento dipolare dipende non solo dalla polarità del legame, ma anche dal comportamento delle coppie di elettroni liberi. Succede che la nuvola elettronica può essere spostata verso l’esterno della molecola, di conseguenza l’equazione per determinare il suo momento dipolare ha una componente aggiuntiva. Nel caso della molecola di ammoniaca, la nuvola è diretta in linea con il momento dipolare del legame, determinando un aumento del momento dipolare risultante. Per la molecola del monossido di carbonio, invece, è vero il contrario, dove la nuvola è diretta nella direzione opposta e di conseguenza riduce il momento dipolare risultante. 
Elettronegatività
È una quantità empirica adimensionale che riflette la tendenza di un dato atomo all’interno di una molecola ad attrarre elettroni verso se stesso. In pratica è la capacità di un atomo o di gruppi funzionali di attrarre la densità elettronica. La scala più utilizzata associata a questa grandezza è quella introdotta da Linus Pauling, che permette di calcolare facilmente, in modo approssimativo, la natura del legame. Per calcolare l’elettronegatività dei singoli elementi lo scienziato ha utilizzato il seguente metodo: presupponiamo che D AA e D BB siano le energie di legame delle molecole a due atomi (A 2 , B 2 ). Chiamiamo l’energia di legame che si verifica nella molecola come D AB . Empiricamente, è stato dimostrato che se un tale legame contiene poco o nessun carattere ionico, la differenza tra i valori D AB e la media geometrica dei valori energetici D AA e D BB è uguale o prossima allo zero. Quando il legame AB presenta evidenti deviazioni dal carattere covalente, tale differenza assume valori positivi, che aumentano all’aumentare della proporzione del carattere ionico. La differenza tra l’elettronegatività (x) dei due atomi coinvolti nel legame è espressa dalla formula: ![]() Quindi, se Pauling assumesse nei suoi calcoli un’elettronegatività del fluoro pari a 4,0, è possibile calcolare le successive elettronegatività degli elementi. Se conosciamo il valore x A degli atomi dell’elemento A e il valore del coefficiente Δ’, allora possiamo calcolare il valore x B utilizzando l’equazione precedente. La scala di Pauling è costruita in modo tale che i suoi valori concordano approssimativamente con i valori del momento di dipolo del legame formato dagli atomi in esame, come possiamo vedere dall’esempio della Tabella 1, che contiene i valori determinati per gli alogenuri di idrogeno . Oltre alla scala sopra descritta, ce ne sono molte altre descritte nella letteratura scientifica, inclusa l’elettronegatività descritta da:
Quindi, se Pauling assumesse nei suoi calcoli un’elettronegatività del fluoro pari a 4,0, è possibile calcolare le successive elettronegatività degli elementi. Se conosciamo il valore x A degli atomi dell’elemento A e il valore del coefficiente Δ’, allora possiamo calcolare il valore x B utilizzando l’equazione precedente. La scala di Pauling è costruita in modo tale che i suoi valori concordano approssimativamente con i valori del momento di dipolo del legame formato dagli atomi in esame, come possiamo vedere dall’esempio della Tabella 1, che contiene i valori determinati per gli alogenuri di idrogeno . Oltre alla scala sopra descritta, ce ne sono molte altre descritte nella letteratura scientifica, inclusa l’elettronegatività descritta da:
- Mulliken, il cui lavoro presupponeva che l’elettronegatività di un elemento fosse direttamente proporzionale alla somma della sua affinità elettronica e della sua energia di ionizzazione. L’affinità elettronica, che è la quantità di energia rilasciata a causa dell’attaccamento di un elettrone a un atomo neutro, e l’energia di ionizzazione pari alla quantità di energia richiesta per staccare un elettrone da un atomo neutro. Le elettronegatività più elevate sono quindi caratteristiche degli atomi che presentano un’elevata affinità elettronica e un’elevata energia di ionizzazione.
- Allred e Rochow, che ipotizzarono la proporzionalità dell’elettronegatività alla misura della forza con cui il nucleo atomico (Z) agisce sugli elettroni di valenza, registrarono come
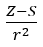 (r – raggio atomico, S – costante di schermatura). Secondo la loro teoria, l’elettronegatività (x) degli elementi può essere calcolata utilizzando la formula:
(r – raggio atomico, S – costante di schermatura). Secondo la loro teoria, l’elettronegatività (x) degli elementi può essere calcolata utilizzando la formula:
![]() Su ciascuna scala, l’elettronegatività dell’idrogeno è vicina al valore di 2,2, con altri valori che variano leggermente. Esempi di elettronegatività degli atomi elementari calcolati secondo le scale Pauling, Mulliken, Allred e Rochow sono mostrati nella Tabella 2 seguente. Tabella 2 Elettronegatività di elementi di esempio sulle scale Pauling (P), Mulliken (M) e Allred e Rochow (AR)
Su ciascuna scala, l’elettronegatività dell’idrogeno è vicina al valore di 2,2, con altri valori che variano leggermente. Esempi di elettronegatività degli atomi elementari calcolati secondo le scale Pauling, Mulliken, Allred e Rochow sono mostrati nella Tabella 2 seguente. Tabella 2 Elettronegatività di elementi di esempio sulle scale Pauling (P), Mulliken (M) e Allred e Rochow (AR)
| Atomo | P | M | AR |
| F | 3,98 | 3,90 | 4.10 |
| O | 3.44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2,95 | 2.83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Sì | 1,90 | 2.25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Nonostante le discrepanze nei calcoli con i tre metodi, il fluoro ha la più alta elettronegatività su ciascuna scala, seguito da ossigeno, azoto e cloro . I valori più bassi sono stati determinati per francio, cesio, rubidio e potassio. Gli elementi che tipicamente non sono metalli hanno elettronegatività superiore al valore di 2, i metalli tipici hanno elettronegatività inferiore a 2. Il valore standard è l’elettronegatività dell’idrogeno sopra menzionata di circa 2,2. 
Elettronegatività nella tavola periodica
Come molte altre proprietà, l’elettronegatività si riflette anche nella disposizione degli elementi chimici nella tavola periodica . Nel gruppo, l’elettronegatività diminuisce con l’aumentare del numero di gusci e del carattere metallico, quindi aumenta nella direzione dal francio all’idrogeno. Nel tempo l’elettronegatività aumenta con un aumento degli elettroni di valenza presenti e una diminuzione del carattere non metallico, quindi dai metalli ai gas nobili .
Elettronegatività e tipo di legame – riepilogo
Conoscendo i singoli valori dell’elettronegatività degli elementi che costituiscono il legame chimico, possiamo dedurne la natura. Se la differenza è compresa tra 0,0 e 0,4, il legame è covalente. Quando la differenza è compresa tra 0,4 e 1,7, il legame è covalente polarizzato. Una differenza superiore a 1,7 nell’elettronegatività degli elementi suggerisce un legame ionico.
