La dissociazione, nel contesto chimico, significa la decomposizione di una sostanza in altre molecole. La parola deriva dal termine latino “ dissociatio ”, che significa “separazione”. Nella nomenclatura scientifica, la dissociazione ha varie definizioni, poiché ha anche il suo significato specifico in psicologia. Ma concentriamoci su cosa significa dissociazione in chimica. A seconda dell'andamento del processo e della sostanza utilizzata, possiamo distinguere quattro diversi tipi di dissociazione. La più popolare è la dissociazione elettrolitica, sebbene la dissociazione termica sia altrettanto importante.

Dissociazione termica
Il processo consiste nella decomposizione di molecole in molecole più piccole o in atomi, sotto l’influenza della temperatura. La relazione più importante è il fatto che la temperatura utilizzata per la dissociazione può essere inferiore se il composto include legami chimici più deboli. Quelli con una maggiore energia necessaria per la decomposizione richiedono una temperatura più elevata. Un esempio comune di termolisi (dissociazione termica) è la caramellizzazione del saccarosio, che avviene a 160 ° C.
Dissociazione elettrolitica
Scoperto nel 1887 dal chimico svedese Svante Arrhenius, è un po’ più complesso rispetto alla dissociazione termica. La dissociazione elettrolitica consiste nella decomposizione di una sostanza, che si verifica quando un solvente (solitamente acqua) agisce sugli ioni liberamente in movimento. Arrhenius ha dimostrato nella sua ricerca che gli ioni prodotti da tale dissociazione fanno sì che la soluzione conduca elettricità. Questa è stata la base per sviluppare la classificazione delle sostanze chimiche in elettroliti (soluzioni in grado di condurre corrente elettrica) e non elettroliti (soluzioni non in grado di condurre corrente elettrica).
Elettroliti
Il termine "elettroliti" ha due significati: dal punto di vista tecnico, è qualsiasi sostanza che può trasferire ionicamente una carica tra gli elettrodi. Di conseguenza, può condurre ionicamente corrente elettrica. L’altro significato più chimico di questo termine si riferisce a sostanze che subiscono una dissociazione elettrolitica come conseguenza della fusione o della dissoluzione. Tali soluzioni (il più delle volte acquose) conducono anche elettricità. Esempi di tali elettroliti includono composti ionici, come cloruro di sodio (sale da cucina), ma anche composti non ionici, ad esempio acido cloridrico o idrossido di potassio . Date le loro proprietà specifiche, gli elettroliti possono essere chiamati conduttori elettrici. Questi possono essere suddivisi in conduttori di classe 1 (metalli, loro leghe e carbonio) e conduttori di classe 2 (soluzioni di basi, acidi e sali ).
Il meccanismo della dissociazione elettrolitica
In un solvente la cui costante dielettrica è elevata (ad esempio, 81 per l’acqua), le forze di attrazione reciproca tra gli ioni in una rete cristallina sono notevolmente ridotte. Questo è quando gli ioni si staccano, il che fa dissolvere la sostanza e secernere ioni che si muovono liberamente nella soluzione. Tali processi si verificano anche a causa dell’interazione tra ioni e molecole d’acqua, che è una conseguenza di una struttura polare di H 2 O. Secondo Nekrasov, il meccanismo d’azione dell’acqua durante la decomposizione di un elettrolita con una struttura ionica viene avviato da lo ione positivo della sostanza, che attrae il polo opposto della molecola d’acqua, allontanando allo stesso tempo lo ione positivo. Il polo opposto agisce allo stesso modo ed entrambi gli ioni vengono circondati dalle molecole d’acqua che hanno attratto. Tale attrazione si verifica in entrambe le direzioni tra molecole dipolari e ioni, il che rende la forza attrattiva degli ioni nell’elettrolita molto inferiore. Pertanto, il meccanismo può essere suddiviso in quattro fasi principali: la transizione della struttura polare in ionica, la formazione della struttura ionica e l’idratazione degli ioni. I legami tra gli ioni e il solvente, prodotti dalla dissociazione, sono chiamati solvati. Se l’acqua è il solvente, allora sono chiamati idrati.
Il guscio di idratazione
È un guscio composto da molecole d’acqua esistenti nelle immediate vicinanze dello ione, orientate con i loro poli opposti. I poli liberi e carichi attraggono ulteriori strati d’acqua, fino a quando la forza attrattiva dello ione diventa più debole dell’energia di movimento molecolare nella soluzione. Il guscio facilita la decomposizione delle molecole di elettroliti in cationi e anioni e costituisce una barriera che impedisce il ricollegamento degli ioni per formare molecole. 
Dissociazione di acidi e basi: la legge dell’azione di massa
Gli acidi forti sono gli acidi che mostrano una dissociazione di vasta portata in una soluzione acquosa, e gli acidi deboli sono quelli che si dissociano solo in piccola parte. Se confrontiamo la forza di diversi acidi, dovremmo anche tenere conto di alcuni fattori come la tendenza delle molecole di acido a cedere i loro protoni o la concentrazione della sostanza in questione. Tuttavia, esiste un valore chimico che non dipende dalla concentrazione ma caratterizza in modo eccellente le proprietà individuali delle molecole: la costante di dissociazione. La derivazione dell’equazione per quel valore dovrebbe iniziare scrivendo l’equazione per la dissociazione acida . Per un esempio con un singolo protone (HX), sarà simile a questo: ![]() Se la soluzione è diluita e l’acido è debole, possiamo applicare la legge dell’azione di massa, che si esprime come segue:
Se la soluzione è diluita e l’acido è debole, possiamo applicare la legge dell’azione di massa, che si esprime come segue: 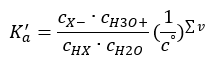 Ci sono due modi per accorciare la relazione presentata. Il primo passo è assumere che la concentrazione di acqua sia costante. Possiamo anche omettere il simbolo c o , in quanto esprime una concentrazione standard pari a 1 mol/dm 3 . Tuttavia, è importante inserirlo nella formula iniziale e tenerne conto quando si determina l’unità. Questo perché le costanti chimiche sono valori adimensionali. Nel frattempo, tutte le concentrazioni utilizzate nella formula sono espresse in mol/dm 3 . Quindi finalmente otteniamo la formula per la costante di dissociazione:
Ci sono due modi per accorciare la relazione presentata. Il primo passo è assumere che la concentrazione di acqua sia costante. Possiamo anche omettere il simbolo c o , in quanto esprime una concentrazione standard pari a 1 mol/dm 3 . Tuttavia, è importante inserirlo nella formula iniziale e tenerne conto quando si determina l’unità. Questo perché le costanti chimiche sono valori adimensionali. Nel frattempo, tutte le concentrazioni utilizzate nella formula sono espresse in mol/dm 3 . Quindi finalmente otteniamo la formula per la costante di dissociazione: 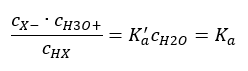 La relazione che esprime la costante di dissociazione acida (K a ) è costituita da valori determinati sperimentalmente, che rientrano nell’intervallo da 10 -10 a 10 8 . Un’operazione popolare consiste nell’usare una formula logaritmica, espressa come un logaritmo negativo della costante di dissociazione, designata come pK a : pK a = -logK a È importante che mentre i valori bassi di K a rappresentano acidi deboli e valori alti rappresentano acidi forti , il pK a cambia in modo opposto. Valori di pK a bassi, generalmente negativi, corrispondono ad acidi forti. Positivi, alti valori di pK a rappresentano acidi deboli. Quando introduciamo un altro concetto, il grado di dissociazione (α), che è il rapporto tra il numero di moli delle molecole di un dato composto, che subiscono la dissociazione (decomposizione in ioni), e il numero totale di moli delle molecole di quel composto, presente nella soluzione, possiamo sviluppare ulteriormente l’equazione. Se ignoriamo la concentrazione molto bassa di ioni idrogeno formati dalla dissociazione dell’acqua e usiamo le concentrazioni di equilibrio di ioni e molecole, possiamo assumere che:
La relazione che esprime la costante di dissociazione acida (K a ) è costituita da valori determinati sperimentalmente, che rientrano nell’intervallo da 10 -10 a 10 8 . Un’operazione popolare consiste nell’usare una formula logaritmica, espressa come un logaritmo negativo della costante di dissociazione, designata come pK a : pK a = -logK a È importante che mentre i valori bassi di K a rappresentano acidi deboli e valori alti rappresentano acidi forti , il pK a cambia in modo opposto. Valori di pK a bassi, generalmente negativi, corrispondono ad acidi forti. Positivi, alti valori di pK a rappresentano acidi deboli. Quando introduciamo un altro concetto, il grado di dissociazione (α), che è il rapporto tra il numero di moli delle molecole di un dato composto, che subiscono la dissociazione (decomposizione in ioni), e il numero totale di moli delle molecole di quel composto, presente nella soluzione, possiamo sviluppare ulteriormente l’equazione. Se ignoriamo la concentrazione molto bassa di ioni idrogeno formati dalla dissociazione dell’acqua e usiamo le concentrazioni di equilibrio di ioni e molecole, possiamo assumere che: 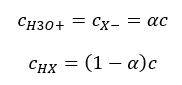 Quindi la costante di dissociazione può essere osservata come segue:
Quindi la costante di dissociazione può essere osservata come segue:  In questa forma, è la dipendenza del grado di dissociazione di un elettrolita dalla sua concentrazione, cioè la legge di diluizione di Ostwald. Se analizziamo elettroliti molto deboli, il grado di dissociazione (α) può essere assunto come <<1, e la formula può essere semplificata come segue:
In questa forma, è la dipendenza del grado di dissociazione di un elettrolita dalla sua concentrazione, cioè la legge di diluizione di Ostwald. Se analizziamo elettroliti molto deboli, il grado di dissociazione (α) può essere assunto come <<1, e la formula può essere semplificata come segue:  Gli acidi che contengono più di un protone subiscono una dissociazione a più stadi e dobbiamo tener conto di tutti i suoi stadi. Per fare un esempio, per l’acido ortofosforico ci sono tre stadi:
Gli acidi che contengono più di un protone subiscono una dissociazione a più stadi e dobbiamo tener conto di tutti i suoi stadi. Per fare un esempio, per l’acido ortofosforico ci sono tre stadi:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO4 2- + H 2 O = PO 4 3- + H 3 O +
Ogni stadio ha una propria costante di equilibrio, che si può notare analogamente al primo:  Le costanti di dissociazione sono tabulate, sia per gli idracidi che per gli ossiacidi.
Le costanti di dissociazione sono tabulate, sia per gli idracidi che per gli ossiacidi.
| Acido | Ka | pK a |
| HF | 6,3· 10-4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27.54 | -1.44 |
| H 3 PO 4 | 6,9·10 -3 | 2.16 |
Tabella 1. Valori di esempio delle costanti di dissociazione per gli acidi. È simile per la stabilizzazione dell’equilibrio delle basi durante la dissociazione. Considerando la regola di esempio B, l’equazione può essere notata come segue: ![]() Quindi, se vogliamo derivare una costante di dissociazione per una base, utilizzando la legge di azione di massa e assumendo che la concentrazione di acqua nella soluzione diluita sia virtualmente costante, otteniamo la seguente formula:
Quindi, se vogliamo derivare una costante di dissociazione per una base, utilizzando la legge di azione di massa e assumendo che la concentrazione di acqua nella soluzione diluita sia virtualmente costante, otteniamo la seguente formula:  Più forte è la base, maggiore è la costante di dissociazione e minore è il valore di pK b , mentre minore è la costante di dissociazione e maggiore è il valore di pK b , più debole è la base.
Più forte è la base, maggiore è la costante di dissociazione e minore è il valore di pK b , mentre minore è la costante di dissociazione e maggiore è il valore di pK b , più debole è la base.
| Base | K b | pK b |
| Idrazina | 3· 10-6 | 5.5 |
| Ammoniaca | 1,78·10 -5 | 4.75 |
| Metilammina | 5.0·10 -4 | 3.3 |
Tabella 2. Valori di esempio delle costanti di dissociazione per le basi. 
Cosa determina la forza degli acidi
Se conosciamo le espressioni delle costanti di dissociazione per acidi particolari, possiamo fare alcune ipotesi vere:
- La forza di un idracide aumenta con l’aumentare del numero atomico dell’elemento legato all’atomo di idrogeno.
- La forza di un idracide diminuisce insieme all’aumento dell’elettronegatività dell’elemento attaccato all’atomo di idrogeno. Ciò può essere fuorviante, poiché in teoria l’aumento dell’elettronegatività dovrebbe favorire l’astrazione dei protoni.
- La dimensione dell’anione formato durante la dissociazione influenza la costante di dissociazione in misura maggiore rispetto all’elettronegatività.
Autodissociazione dell’acqua
Un interessante esempio di dissociazione è la decomposizione delle molecole d’acqua. Poiché sono in grado sia di attrarre protoni che di cederli, l’acqua pura subisce un’autodissociazione in piccola parte, secondo la seguente equazione: H 2 O + H 2 O ↔ H 3 O + + OH – Come per gli acidi e basi, è anche possibile applicare la legge dell’azione di massa, che include le concentrazioni di equilibrio dell’acqua non dissociata così come i suoi anioni e cationi: 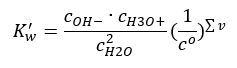 Si scopre che le concentrazioni di cationi H 3 O + e OH – anioni sono così piccole rispetto all’acqua non dissociata che anche la loro alterazione praticamente non cambia la concentrazione dell’acqua non dissociata. Ciò consente di assumere tale valore come costante e di convertire l’equazione nella seguente forma: K w = c OH – · c H3O + È un aspetto particolarmente importante nell’ambito dei calcoli chimici, e tale costante è riferita come prodotto ionico dell’acqua. È anche spesso usato come logaritmo negativo, designato come pK w . Questo è uguale a –logK w . Sulla base dell’equazione, se l’equilibrio ionico dell’acqua è disturbato a causa della fornitura di ioni H 3 O + , allora per mantenere la costanza del prodotto ionico dobbiamo ridurre la concentrazione di ioni OH. Allo stesso modo, un eccesso di ioni OH – riduce la concentrazione di cationi. Il prodotto di queste concentrazioni deve essere costante. Gli esperimenti hanno dimostrato che K w a una temperatura di 298 K è 10 -14 . Pertanto, possiamo anche notare l’equazione valida per l’acqua pura come segue:
Si scopre che le concentrazioni di cationi H 3 O + e OH – anioni sono così piccole rispetto all’acqua non dissociata che anche la loro alterazione praticamente non cambia la concentrazione dell’acqua non dissociata. Ciò consente di assumere tale valore come costante e di convertire l’equazione nella seguente forma: K w = c OH – · c H3O + È un aspetto particolarmente importante nell’ambito dei calcoli chimici, e tale costante è riferita come prodotto ionico dell’acqua. È anche spesso usato come logaritmo negativo, designato come pK w . Questo è uguale a –logK w . Sulla base dell’equazione, se l’equilibrio ionico dell’acqua è disturbato a causa della fornitura di ioni H 3 O + , allora per mantenere la costanza del prodotto ionico dobbiamo ridurre la concentrazione di ioni OH. Allo stesso modo, un eccesso di ioni OH – riduce la concentrazione di cationi. Il prodotto di queste concentrazioni deve essere costante. Gli esperimenti hanno dimostrato che K w a una temperatura di 298 K è 10 -14 . Pertanto, possiamo anche notare l’equazione valida per l’acqua pura come segue:  La dissociazione è anche correlata al valore del pH della soluzione. Le soluzioni con uguali concentrazioni di cationi H 3 O + e OH – anioni mostrano un pH neutro. Nelle soluzioni acide la concentrazione di cationi è superiore a 10 -7 mol/l, mentre nelle soluzioni alcaline è inferiore a 10 -7 mol/l.
La dissociazione è anche correlata al valore del pH della soluzione. Le soluzioni con uguali concentrazioni di cationi H 3 O + e OH – anioni mostrano un pH neutro. Nelle soluzioni acide la concentrazione di cationi è superiore a 10 -7 mol/l, mentre nelle soluzioni alcaline è inferiore a 10 -7 mol/l.
