Nel caso di reazioni chimiche, la conversione completa dei substrati in prodotti si osserva solo per una piccola parte di essi. La stragrande maggioranza, compresi quelli che si verificano nel nostro corpo, sono reversibili. Per tali processi, viene stabilito uno stato di equilibrio chimico. Questo è un concetto estremamente importante in chimica, che è associato, ad esempio, al principio di Le Chatelier (o alla legge dell'equilibrio). La conoscenza delle leggi e dei principi di base riguardanti l'equilibrio chimico consente, ad esempio, di prevedere molte reazioni o condurre processi tecnologici in modo più efficiente.
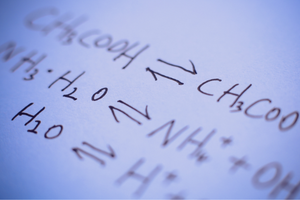
Reazioni reversibili e irreversibili
Prendendo in considerazione il corso delle reazioni chimiche, si può fare una divisione generale – in reazioni reversibili e irreversibili. Tuttavia, va ricordato che in realtà non ci sono reazioni irreversibili al 100%e la qualificazione a un determinato gruppo si basa sull’effetto finale prevalente.
Reazioni irreversibili
In questo caso, i substrati nel sistema reagiscono e danno luogo a prodotti specifici. Tuttavia, non vi è alcuna trasformazione inversa: prodotti in substrati . Nella formula, una singola freccia è contrassegnata tra i reagenti e la freccia punta verso i prodotti. Le reazioni irreversibili sono principalmente tutte quelle in cui si formano i precipitati. In pratica sono insolubili in acqua e non possono essere ricostituiti. La reversibilità del processo è difficile da ottenere anche nel caso di reazioni che avvengono in sistemi aperti, cioè in un beaker o in un pallone sferico, da cui uno dei prodotti risultanti, ad esempio l’anidride carbonica, può fuoriuscire liberamente, ma cambiando le condizioni della reazione, cioè trasferendola in un sistema chiuso, può essere resa reversibile. Il gruppo delle reazioni irreversibili comprende anche tutti i processi in cui l’interazione tra le molecole del prodotto avviene in misura molto minore rispetto a quella tra i substrati. Pertanto, tale processo avviene in entrambe le direzioni, ma a causa del fatto che la ricostituzione dei substrati è trascurabile, in pratica sono classificate come reazioni irreversibili.
Reazioni reversibili
Si tratta di reazioni in cui si formano prodotti a partire da substrati e, allo stesso tempo, avviene con intensità comparabile il processo inverso, ovvero la ricostituzione di substrati a partire da prodotti. Nella formula di reazione, due frecce sono poste tra i reagenti, con le frecce che puntano in direzioni opposte, per indicare la reversibilità delle reazioni in atto. Le reazioni reversibili sono principalmente quelle che si svolgono in sistemi chiusi. Le molecole di substrati e prodotti non sono in grado di lasciare l’ambiente di reazione e si scontrano tra loro, creando prodotti e ricostituendo substrati. Un esempio di tale reazione è la produzione di ioduro di idrogeno da iodio e idrogeno.
Lo stato di equilibrio chimico
Se una particolare reazione può verificarsi, o se è reversibile o irreversibile, dipende in gran parte dalle particolari condizioni di processo e dal tipo di processo. Se ha luogo una reazione reversibile, cioè i substrati si trasformano in prodotti come risultato di una reazione chimica e, allo stesso tempo, come risultato di collisioni di molecole di prodotto, i substrati subiscono una ricreazione, quindi a un certo punto nel tempo in cui si verificano queste reazioni, si stabilisce uno stato di equilibrio chimico . In altre parole, le concentrazioni di substrati e prodotti nel sistema sono a un livello costante: la loro quantità non cambia nonostante la reazione continua. Nello stato di equilibrio chimico, le velocità di reazione in entrambe le direzioni sono le stesse. L’equilibrio chimico, in determinate condizioni, significa lo stato più stabile per un particolare sistema. Il fabbisogno energetico è quindi molto basso. La costante di equilibrio chimico, K , è un coefficiente che descrive l’equilibrio di due reazioni reversibili. È definito come il quoziente delle concentrazioni di prodotti e substrati elevato alle potenze corrispondenti ai coefficienti stechiometrici che sono stati misurati nello stato di equilibrio chimico. La formula per la costante fu derivata nel 1864 come la cosiddetta legge dell’azione di massa. Va ricordato che questo è un valore caratteristico per una particolare reazione. Numerosi fattori influenzano lo stato di equilibrio chimico. Questi sono alcuni di loro:
- Temperatura,
- volume del sistema di reazione,
- pressione,
- concentrazione dei reagenti.
Ciò che è importante, la posizione dello stato di equilibrio non è influenzata dall’aggiunta o dalla modifica del catalizzatore di reazione. Il suo compito è solo quello di accorciare il tempo durante il quale si raggiunge l’equilibrio. 
Principio di Le Chatelier (la Legge dell’Equilibrio)
Modificando determinate condizioni di reazione, possiamo influenzare il suo equilibrio. Il sistema cercherà sempre di mantenere l’equilibrio, perché gli è energeticamente favorevole (minimo dispendio energetico). Di conseguenza, ci saranno cambiamenti che contrasteranno i fattori che sbilanciano il sistema. Questo fenomeno fu spiegato nel 1881 ed è noto oggi come principio di Le Chatelier-Braun o come Legge dell’Equilibrio. Permette di comprendere la risposta del sistema al variare delle condizioni di una reazione, che si trova in uno stato di equilibrio chimico. L’aggiunta di una delle sostanze reagenti al sistema provoca un disturbo all’equilibrio. Le concentrazioni dei singoli reagenti cambiano. Pertanto, per contrastare ciò, il sistema tende a produrre più prodotto (quando è stato aggiunto un substrato) oa ricostituire il substrato (quando è stata aggiunta una certa quantità di prodotto). La modifica della temperatura di reazione ha un impatto enorme, soprattutto per i processi endotermici ed esotermici. Nel primo caso è necessario fornire energia al sistema sotto forma di calore, quindi aumentando la temperatura dell’intero processo si sposterà l’equilibrio verso destra (abbassamento verso sinistra), verso la formazione di più prodotto . L’opposto sarà il caso delle reazioni esotermiche, dove uno dei prodotti è il calore. La temperatura non ha alcun effetto sull’equilibrio della reazione, dove non si osserva alcun effetto termico. Nel caso di reazioni che avvengono in fase gassosa, la pressione è un aspetto molto importante. Aumentando il valore di questo parametro, cioè riducendo il volume di reazione del sistema, si causerà uno spostamento dell’equilibrio di reazione. La direzione dei cambiamenti dipende dai coefficienti stechiometrici nell’equazione di reazione. Questo parametro non influenzerà l’equilibrio chimico della reazione in cui la somma dei coefficienti stechiometrici dei substrati gassosi e dei prodotti è la stessa. Vale la pena ricordare che quando il sistema viene espulso dall’equilibrio chimico, si applicherà la legge dell’equilibrio e, di conseguenza, verrà raggiunto un nuovo stato di equilibrio.
























































































































