In chimica, alcuni composti chimici formano legami speciali con le molecole d'acqua. Questi non sono legami chimici, ma interazioni a corto raggio che determinano specificamente le proprietà di questi composti. Stiamo parlando degli idrati. Le loro proprietà trovano facile impiego in settori industriali selezionati. Il sale idrato più diffuso è senza dubbio il gesso, o solfato di calcio biidrato (VI), che rappresenta un'importante materia prima nel settore edile. Gli idrati sono anche ottimi indicatori del contenuto di umidità. Ciò è legato al fatto che il colore del sale anidro è spesso diverso da quello del sale idrato.

Idrata
Gli idrati non sono composti chimici in cui si verificano legami chimici , come legami covalenti , tra le molecole di acqua e le molecole di un dato sale . Inoltre non sono composti di coordinazione. Caratteristica di queste strutture è la formazione di legami idrogeno, che sono molto più deboli in termini di forza rispetto ai legami chimici. Gli idrati sono strutturati sotto forma di un reticolo cristallino. In esso le molecole d’acqua sono distribuite in modo irregolare. Viene spesso utilizzato il termine “acqua di cristallizzazione”. Gli idrati si ottengono per idratazione . Le molecole di sale, in particolare i derivati degli acidi inorganici, hanno maggiori probabilità di subire questa reazione. L’idratazione comporta la trasformazione dei cristalli anidri in cristalli idratati. Può causare un cambiamento nella massa minerale, ma non la distrugge. L’idratazione spesso accompagna altri processi, come la carbonatazione. I prodotti chimici di idratazione, in condizioni normali, sono caratterizzati da un’elevata igroscopicità , cioè da una forte affinità per le molecole d’acqua. Tali sostanze sono in grado, ad esempio, di assorbire l’umidità dell’aria . Un altro modo per ottenere gli idrati è cristallizzarli da soluzioni acquose. Le formule molecolari degli idrati si formano scrivendo la formula del sale e indicando il numero di molecole di acqua idratata. Per fornire una notazione generale, la lettera ‘n’ viene posta prima di ‘H 2 O’. I suoi valori sono maggiori di uno e corrisponde al numero di molecole d’acqua attaccate. Le distinzioni più comuni sono tra idrati con n=½ (emiidrato), n= 1 (monoidrato), n=2 (diidrato) e n=3 (triidrato). È importante sottolineare che la stessa sostanza può attaccare un numero diverso di molecole d’acqua. ![]()
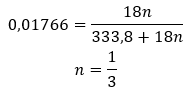 Dato che ci sono legami idrogeno tra le molecole di sale e le molecole di acqua, questi composti non mostrano una resistenza soddisfacente alle temperature elevate. Quando vengono riscaldati, si disintegrano e si trasformano in forme anidri. Gli idrati si dissolvono molto bene in acqua. Nelle soluzioni acquose vengono rilasciate molecole di acqua idratate attaccate al sale. Questo fatto dovrebbe essere preso in considerazione, ad esempio, quando si preparano soluzioni di queste sostanze. La mancata considerazione del grado di idratazione di un dato composto comporta errori, se non altro nella determinazione della concentrazione della soluzione. Una caratteristica importante dei sali idrati è il cambiamento del loro colore dovuto all’attaccamento delle molecole d’acqua nella reazione di idratazione. Va notato che le forme idrate mostrano un’igroscopicità significativamente inferiore rispetto ai sali anidri.
Dato che ci sono legami idrogeno tra le molecole di sale e le molecole di acqua, questi composti non mostrano una resistenza soddisfacente alle temperature elevate. Quando vengono riscaldati, si disintegrano e si trasformano in forme anidri. Gli idrati si dissolvono molto bene in acqua. Nelle soluzioni acquose vengono rilasciate molecole di acqua idratate attaccate al sale. Questo fatto dovrebbe essere preso in considerazione, ad esempio, quando si preparano soluzioni di queste sostanze. La mancata considerazione del grado di idratazione di un dato composto comporta errori, se non altro nella determinazione della concentrazione della soluzione. Una caratteristica importante dei sali idrati è il cambiamento del loro colore dovuto all’attaccamento delle molecole d’acqua nella reazione di idratazione. Va notato che le forme idrate mostrano un’igroscopicità significativamente inferiore rispetto ai sali anidri.
Idrati di composti inorganici
I sali degli acidi inorganici sono le sostanze che hanno maggiori probabilità di formare idrati con le molecole d’acqua. Gli idrati più comuni di composti inorganici includono:
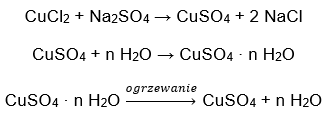
- Il solfato di rame (II) idrato (VI), CuSO 4 – il solfato di rame (II) (VI) adotta vari gradi di idratazione. Il numero massimo di molecole d’acqua attaccate è cinque. Come risultato del riscaldamento del pentaidrato di questo sale, le molecole d’acqua vengono eliminate. Si formano i primi due e un triidrato e, con l’ulteriore riscaldamento del sistema, si può ottenere solfato di rame (II) monoidrato (VI). Per eliminare l’ultima molecola d’acqua è necessario riscaldare il composto ad una temperatura superiore a 200 ᵒC. Il solfato idrato di rame (II) (VI) è di colore blu, causato dalla presenza di acqua di cristallizzazione attorno agli ioni rame. Mentre il sale anidro è di colore bianco. La sua elevata igroscopicità e capacità di formare idrati viene utilizzata per rimuovere l’umidità da alcuni liquidi.
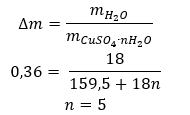
- Cloruro di cobalto (II) idrato, CoCl 2 – cloruro di cobalto (II) anidro è altamente igroscopico. Grazie alla sua forte affinità per le molecole d’acqua, è in grado di assorbire l’umidità anche dall’aria. Questo processo porta alla formazione di idrati di questo sale. La forma idrata più comune è il cloruro di cobalto (II) esaidrato – CoCl 2 * 6H 2 Un’altra forma è la molecola diidrata. Questo sale mostra anche la capacità di cambiare colore a seconda del suo contenuto di umidità. Il sale anidro è blu, il diidrato assume un colore rosa-viola e il colore della molecola esaidrata è rosso intenso.
- Solfato di sodio idrato (VI), Na 2 SO 4 – questo sale esiste sotto forma di due idrati: eptaidrato (cinque molecole d’acqua nella struttura) e decaidrato (dieci molecole d’acqua nella struttura). La forma anidra del solfato di sodio (VI) si trova in natura come il raro minerale thénardite. Il solfato di sodio tenidrato (VI) è il cosiddetto sale di Glauber. È ampiamente utilizzato nella produzione di vetro, carta, detersivi per bucato e soda. Il sale di Glauber è anche uno degli ingredienti necessari per la produzione del pigmento blu oltremare. Inoltre, il composto ha un effetto terapeutico sul sistema digestivo, grazie alle sue proprietà lassative.

Gesso
Un esempio di sale idrato inorganico di importanza globale e di ampia applicazione è il gesso. È un minerale costituito dalla forma idrata del solfato di calcio (VI), CaSO 4 . Il gesso cristallino è il diidrato di questo sale. In condizioni naturali si forma durante l’evaporazione dell’acqua salata di laghi e fiumi, a temperature inferiori a 42ᵒC. Il solfato di calcio anidro (VI) è anidrite. Viene anche chiamato gesso anidro. Il gesso da costruzione, invece, è solfato di calcio emiidrato (VI). La forma di questo sale ottenuta dipende dalla temperatura prevalente durante la lavorazione della roccia sedimentaria madre. Il gesso utilizzato in edilizia è solitamente una miscela di diverse forme di sale di calce idrata. 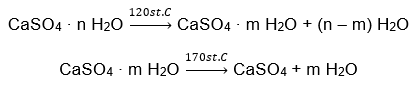
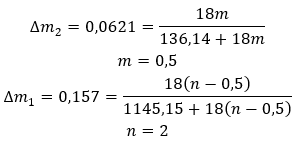 Le possibilità di applicazione del gesso sono molto ampie, soprattutto nel settore edile. Gli usi più importanti di questo sale idrato sono elencati di seguito:
Le possibilità di applicazione del gesso sono molto ampie, soprattutto nel settore edile. Gli usi più importanti di questo sale idrato sono elencati di seguito:
- Nel settore edile il gesso viene utilizzato negli elementi di finitura. È uno dei componenti di semilavorati sfusi, malte, collanti, finiture a base gesso e componenti di assemblaggio preconfezionati, ad esempio cartongesso.
- La medicina usa il gesso per rinforzare gli arti rotti. Le bende di gesso sono considerate delicate sulla pelle. Inoltre il materiale viene utilizzato anche nei laboratori odontotecnici.
- L’industria utilizza il gesso nei laboratori di modellazione e progettazione. I calchi in gesso sono molto adatti per modellare vari oggetti utilitaristici.
- Il gesso è un additivo per alcuni fertilizzanti utilizzati in agricoltura.

Clatrati di metano
I clatrati di metano appartengono ad un gruppo di composti noti come gas idrati. Sono responsabili della maggior parte dei rapidi cambiamenti climatici nella storia della Terra. I clatrati di metano sono spesso indicati anche come idrati di metano o ghiaccio di metano. Formano una forma solida di acqua e metano . Le loro molecole si distinguono per la loro struttura cristallina. Si formano sotto una maggiore pressione. Si presentano sotto forma di solidi bianchi, inodori, spesso simili, nell’aspetto esterno, al ghiaccio. È interessante notare che al tatto assomigliano al polistirolo . I clatrati sono raggruppamenti chimici unici . Le molecole d’acqua formano una struttura che ricorda una gabbia. Il metano è immagazzinato all’interno di questa gabbia. È importante sottolineare che le due sostanze non formano legami chimici tra loro. Tipicamente, i clatrati di metano sono costituiti da 46 molecole d’acqua che circondano due gabbie piccole e sei medie. Al loro interno sono intrappolate le molecole di metano. È noto anche che i clatrati sono costituiti da 136 molecole d’acqua con all’interno 16 gabbie piccole e otto grandi gabbie di gas metano. Negli ultimi anni, quantità significative di questa risorsa sono state scoperte sul fondo degli oceani. Sta suscitando molto interesse per la possibilità di estrarre notevoli quantità di metano, che può essere utilizzato, ad esempio, per scopi energetici. I clatrati di metano bruciano con fiamma uniforme, di colore rossastro. Dopo la combustione rimane acqua fusa. Il metano estratto in questo modo può rappresentare una buona alternativa alle fonti convenzionali di idrocarburi , ma rappresenta anche una vera minaccia per il clima. Le conoscenze sullo sfruttamento del metano derivante dai clatrati accumulati sui fondali oceanici sono ancora insufficienti. Il rilascio incontrollato di quantità significative di questo gas può essere molto pericoloso, poiché aumenta l’effetto serra molto più fortemente del biossido di carbonio.
