Questo è un gruppo di composti inorganici formati dalla combinazione di vari elementi con l'ossigeno. La loro formula generale è X n O m , dove "X" è un qualsiasi elemento, "O" è l'ossigeno, sempre nel secondo stato di ossidazione, e le lettere "n,m" nell'indice inferiore sono coefficienti. Esempi di ossidi: acqua H 2 O, ossido di potassio K 2 O, ossido di alluminio Al 2 O 3 , ossido di calcio CaO e monossido di carbonio (II) CO.

Classificazione degli ossidi
Gli ossidi possono essere classificati in diverse categorie. La classificazione più generale è la distinzione tra ossidi metallici, ad esempio ossido di litio, ossido di magnesio, ossido di alluminio, ossido di ferro e ossidi non metallici, tra cui ossido di carbonio, ossido di azoto, ossido di zolfo e ossido di cloro . Un altro criterio è la classificazione in base al loro stato fisico. Quasi tutti gli ossidi metallici e alcuni non metalli (SiO 2 , P 4 O 10 ) sono solidi. L’acqua, l’ossido di zolfo (VI) e l’ossido di manganese (VII) sono liquidi. Gli ossidi non metallici come CO, CO 2 , SO 2 , NO i NO 2 sono gas. Gli ossidi possono anche essere classificati in base al tipo di legami che si formano in essi. L’ossido di magnesio MgO, l’ossido di calcio CaO o l’ossido di sodio Na 2 O contengono ioni O 2- e legami ionici, da qui il loro nome: ossidi ionici. Un altro gruppo sono gli ossidi covalenti, ad esempio monossido di carbonio (II) CO, ossido nitrico (II) NO o ossido di zolfo (IV) SO 2 , in cui il legame tra l’atomo di ossigeno e l’elemento ha la forma di un legame covalente polare.
Il carattere chimico degli ossidi
Per i chimici, la classificazione più interessante è basata sulla natura chimica degli ossidi. Esistono quattro categorie principali di ossidi: acido, basico, neutro e anfotero.
- Gli ossidi acidi , talvolta chiamati anche anidridi acide, si distinguono per il fatto che reagiscono con gli alcali con formazione di sale. Una parte significativa degli ossidi acidi forma soluzioni appropriate di ossiacidi dopo la dissoluzione in acqua. Ciò si applica, ad esempio, all’ossido di zolfo (IV), che quando disciolto in acqua produce acido solforico (IV) , e all’ossido di cromo (VI) che si dissolve in acido cromico (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 C’è un piccolo gruppo di ossidi acidi che sono insolubili in acqua. Tuttavia, sono solubili in soluzioni di alcali forti , ad esempio silicio ( IV) ossido SiO 2 , ossido di molibdeno (VI) MoO 3 e ossido di tungsteno (VI) WO 3 . Le loro reazioni con gli alcali confermano il loro carattere acido: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O As a regola, gli ossidi acidi sono ossidi non metallici e ossidi metallici nei loro stati di ossidazione più elevati possibili. Se un dato elemento forma più ossidi a diversi stati di ossidazione, come ad esempio il cromo, le proprietà acide dei suoi ossidi aumentano con l’aumentare del suo stato di ossidazione:
- l’ossido di cromo (II) CrO è alcalino,
- l’ossido di cromo (III) Cr 2 O 3 ha proprietà anfotere,
- l’ossido di cromo (VI) CrO 3 è acido.

- Gli ossidi alcalini sono quei composti di ossigeno con metalli che reagiscono con acidi per dare prodotti sotto forma di sali corrispondenti. Alcuni di essi, cioè ossidi di elementi del primo e secondo gruppo della tavola periodica, escluso il berillio, sono caratterizzati anche da una reazione con l’acqua con conseguente formazione di idrossidi alcalini. Si verifica, ad esempio, durante la reazione dell’ossido di sodio, dell’ossido di litio e dell’ossido di bario con l’acqua:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Esistono anche ossidi alcalini che non si sciolgono in acqua ma solo in soluzioni acide. Questi includono, ad esempio, ossido di manganese (II) e ossido di ferro (II): MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Gli ossidi neutri sono il gruppo di ossidi meno reattivo. Non reagiscono né con gli acidi né con gli alcali. Sono anche insolubili in acqua. Esempi di questo gruppo di ossidi sono il monossido di carbonio (II) CO e l’ossido nitrico (II) NO.
- Gli ossidi anfoteri sono l’esatto opposto degli ossidi neutri e sono sia acidi che alcalini allo stesso tempo. Ciò significa che reagiscono sia con alcali forti che con acidi. I prodotti di queste reazioni sono sempre sali, e l’elemento che inizialmente si combina con l’ossigeno si trasforma in un opportuno catione o anione del residuo acido. L’unica somiglianza con gli ossidi neutri è la loro scarsa solubilità in acqua. Esempi di ossidi anfoteri sono: ossido di berillio BeO, ossido di alluminio Al 2 O 3 , ossido di cromo (III), ossido di stagno (II) SnO, ossido di piombo (II) PbO e ossido di zinco ZnO. Reagendo con soluzioni acquose di alcali forti, ad esempio con una soluzione acquosa di idrossido di sodio , formano sali complessi . Nei loro residui acidi, atomi o ioni del metallo, che deriva dall’ossido, sono presenti in complessi con un numero appropriato di gruppi idrossilici. Il loro numero dipende dal numero di coordinazione dell’elemento dato. Ad esempio, gli atomi derivati da ossidi di MO (M – metallo), come l’ossido di berillio BeO, hanno il numero di coordinazione 4. Gli atomi derivati da ossidi di tipo M 2 O 3 , ad esempio Al 2 O 3 , possono avere due diversi numeri di coordinazione, e a seconda delle condizioni di reazione è 4 o 6. Esempi di reazioni di ossidi anfoteri:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] sodio tetraidrossizincato Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] tetraidrossialluminato di potassio Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] esaidrossialluminato di sodio Alcuni ossidi , come l’ossido di zinco e l’ossido di manganese (IV), hanno proprietà anfotere piuttosto specifiche. Quest’ultimo, né in condizioni normali né standard, non reagisce con gli alcali. Entrambi, invece, reagiscono con essi fondendosi con alcali solidi, ad esempio: 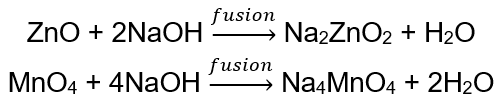

Ottenere ossidi
- Sintesi diretta di elementi: a) sintesi di atomi di zolfo e atomi di ossigeno con formazione di ossido di zolfo (IV) S + O → SO 2 b) sintesi di atomi di magnesio e atomi di ossigeno con formazione di ossido di magnesio 2Mg + O 2 → 2MgO c) sintesi di atomi di carbonio e atomi di ossigeno con formazione di monossido di carbonio (IV) C + O 2 → CO 2
- Decomposizione termica di sali , idrossidi e ossidi: a) decomposizione del carbonato di calcio in ossido di calcio e monossido di carbonio (IV) CaCO 3 → CaO + CO 2 b) decomposizione dell’idrossido di rame (II) in ossido di rame (II) e acqua Cu( OH) 2 → CuO + H 2 O c) decomposizione dell’ossido di manganese (IV) in ossido di manganese (III) e ossigeno 4MnO 2 → 2Mn 2 O 3 + O 2
- Ossidazione di ossidi a stati di ossidazione inferiori, con aumento della loro valenza: a) ossidazione dell’ossido di zolfo (IV) a ossido di zolfo (VI) 2SO 2 + O 2 → 2SO 3 b) ossidazione dell’ossido nitrico (II) a nitrico ( IV) ossido 2NO + O 2 → 2NO 2 c) ossidazione del monossido di carbonio (II) a monossido di carbonio (IV) (IV) 2CO + O 2 → 2CO 2
- Riduzione degli ossidi a stati di ossidazione superiori, con diminuzione della loro valenza: a) riduzione del monossido di carbonio (IV) a monossido di carbonio (II) (II) CO 2 + C → 2CO b) riduzione dell’ossido di stagno (II) a stagno (I) ossido 2SnO + O 2 → 2SnO 2
- Combustione di composti organici: a) combustione di metano in ossigeno con formazione di monossido di carbonio (IV) e acqua CH 4 + 2O 2 → CO 2 + 2H 2 O b) combustione di ammoniaca in ossigeno per ottenere ossido nitrico (II) e acqua 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Reazione di ossiacidi instabili: a) decomposizione dell’acido carbonico (IV) in monossido di carbonio (IV) e acqua: H 2 CO 3 → CO 2 + H 2 O b) decomposizione dell’acido solforico (IV) in ossido di zolfo (IV) e acqua: H 2 SO 3 → SO 2 + H 2 O
