È uno dei più antichi metodi strumentali utilizzati nell'analisi chimica. Le sue fondamenta furono poste da L. Galvani, CA Volta, JW Gibbs e W. Nernst tra il XVIII e il XIX secolo. Le misurazioni eseguite con metodi potenziometrici utilizzano la forza elettromotrice (EMF) di una cella costituita da due elettrodi immersi nella soluzione testata. Il valore di tale forza dipende direttamente dai potenziali degli elettrodi utilizzati. Questi a loro volta dipendono dall'attività degli ioni contenuti nella soluzione elettrolitica e dalla natura dei processi elettrodici.
Diagramma dei processi degli elettrodi esemplificati dalla cella Daniell
La cella Daniell è composta da due semicelle, ciascuna composta da un metallo immerso nella soluzione del proprio sale. Le semicelle componenti sono i sistemi di Cu (s) /Cu 2+ (aq) e Zn (s) /Zn 2+ (aq) . Ciascuno di essi subisce una delle seguenti reazioni redox:
- riduzione
Cu 2+ (aq) + 2e – → Cu (s)
- ossidazione
Zn (s) → Zn 2+ (aq) + 2e – Quando combiniamo entrambe le reazioni, otteniamo l’equazione completa per la reazione che si verifica nella cella: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Per misurare una particolare forza elettromotrice della cella, dobbiamo collegare le semicelle tramite un ponte salino e collegare gli elettrodi ad un voltmetro . Così possiamo misurare la differenza di potenziale tra i singoli elettrodi, che rappresenta il valore EMF della cella . Secondo la convenzione IUPAC, il diagramma della cella di Daniell si presenta come segue: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Le linee singole rappresentano l’interfaccia e le linee doppie rappresentano il ponte salino. Il potenziale all’interfaccia è il risultato delle reazioni di ossidazione e riduzione. Per le celle, assumiamo che l’elettrodo dove avviene l’ossidazione sia l’anodo con il segno ϴ, mentre l’altro sia un catodo positivo dove avviene la riduzione . La notazione inizia con l’anodo e il catodo è annotato sul lato destro . La forza elettromotrice di una tale cella può essere calcolata sulla base della seguente formula: EMF = potenziale catodo – potenziale anodo
Potenziale di elettrodo standard
Questo termine è stato introdotto per sistematizzazione, e un determinato potenziale di un elettrodo è considerato “standard” se soddisfa alcune condizioni. La misura deve essere eseguita a 298 K, l’attività degli ioni attivi deve essere pari a 1 mol/dm 3 , e l’elettrodo di riferimento deve essere un normale elettrodo a idrogeno, in quanto si assume che il potenziale di tale elettrodo sia 0,0000 V.
Forza elettromotrice della cellula
Il valore EMF cambia insieme al cambiamento dell’attività degli ioni presenti nella cellula. L’equazione che riflette questa relazione è chiamata equazione di Nernst : 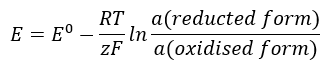 Utilizza i seguenti simboli: potenziale di elettrodo (E), potenziale di elettrodo standard (E 0 ), costante di gas (R) pari a 8,312 J/K·mol, temperatura (T), numero di elettroni coinvolti nella reazione elettrochimica degli elettroni (z), costante di Faraday (F) pari a 9,64853·10 4 C/mol, e l’attività degli ioni nelle forme ridotta e ossidata. Per i solidi, si assume che l’attività (a) sia 1.
Utilizza i seguenti simboli: potenziale di elettrodo (E), potenziale di elettrodo standard (E 0 ), costante di gas (R) pari a 8,312 J/K·mol, temperatura (T), numero di elettroni coinvolti nella reazione elettrochimica degli elettroni (z), costante di Faraday (F) pari a 9,64853·10 4 C/mol, e l’attività degli ioni nelle forme ridotta e ossidata. Per i solidi, si assume che l’attività (a) sia 1. 
Strumentazione potenziometrica
Il set base per le misure potenziometriche è costituito da due componenti: una coppia di elettrodi immersi nella soluzione in esame e un dispositivo di misurazione . Il primo componente è la cella di misura , mentre il secondo permette la misura effettiva della sua forza elettromotrice. La parte più importante di una cella sono gli elettrodi. Secondo il loro meccanismo d’azione, possono essere classificati in quattro gruppi.
Ponte di sale
Un elemento importante di qualsiasi cella è il ponte salino, che consente all’elettrodo di riferimento di contattare la soluzione testata . La caratteristica fondamentale di una cellula con transfert è il contatto tra elettroliti di diversa concentrazione e composizione. Per evitare la miscelazione dell’elettrolita del ponte con la soluzione testata, vengono utilizzate piccole superfici di contatto.
Elettrodi del primo tipo
Questi elettrodi sono costituiti da un metallo o da un gas immerso nella soluzione contenente i propri ioni . Sono detti anche elettrodi reversibili al catione , in quanto sulla loro superficie avviene la seguente reazione reversibile: M 0 ↔ M n+ + ne Un esempio di elettrodi del primo tipo è l’elettrodo a idrogeno.
Elettrodi del secondo tipo
Tali elettrodi sono costruiti con un metallo ricoperto del suo sale scarsamente solubile . Il sistema è immerso in un sale liberamente solubile, che contiene lo stesso anione del sale scarsamente solubile. Questi elettrodi sono detti elettrodi reversibili all’anione comune , in quanto sulla loro superficie avviene la seguente reazione: M 0 + A – ↔ MA + e Esempi di elettrodi del secondo tipo sono gli elettrodi argento-cloruro d’argento o al calomelano.
Elettrodi del terzo tipo
Questi sono composti da metalli circondati da due strati: il primo strato sottile costituito da un sale scarsamente solubile di quel metallo, e il secondo strato costituito da un sale leggermente più solubile che contiene lo stesso anione. Sono elettrodi reversibili a catione comune , in quanto sulla loro superficie avviene la seguente reazione: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Elettrodi redox
La struttura di tali elettrodi è caratterizzata dall’utilizzo di un metallo chimicamente inerte, ad esempio platino o oro, che viene immerso in una soluzione contenente una sostanza sia in forma ridotta che ossidata . Un esempio di tali elettrodi è l’elettrodo chinidrone.
Funzioni degli elettrodi in un sistema
In termini di applicazione in un sistema analitico, distinguiamo:
- elettrodi di riferimento , che mantengono un potenziale costante indipendentemente dalle condizioni di misurazione o dalla concentrazione della soluzione testata.
- elettrodi indicatori , il cui potenziale cambia se la soluzione in esame contiene ioni, ai quali sono sensibili.
Elettrodi di riferimento
La misura potenziometrica si basa sul confronto del potenziale dell’elettrodo indicatore con l’elettrodo di riferimento . Per questo motivo tali elettrodi devono essere caratterizzati da:
- potenziale stabile,
- potenziale riproducibile e indipendenza dalla temperatura,
- versatilità e facilità d’uso,
- bassa resistenza elettrica,
- potenziale di diffusione riproducibile e basso,
- poco flusso dell’elettrolita dell’elettrodo alla soluzione testata.
Un elettrodo di riferimento comunemente utilizzato è l’elettrodo argento-cloruro d’argento (Ag/AgCl/KCl), che reagisce alla presenza di ioni cloruro. È costruito con un filo d’argento ricoperto da uno strato di cloruro d’argento. Un altro esempio è l’elettrodo al calomelano (Pt/Hg/Hg 2 Cl 2 /KCl), il cui potenziale dipende anche dall’attività in una soluzione di ioni cloruro.
Elettrodi indicatori
Per gli elettrodi di questa categoria il loro potenziale cambia in presenza di ioni testati nella soluzione . Ciò significa che il loro potenziale dipende direttamente dall’attività, quindi anche dalla concentrazione, della soluzione in cui sono posti . I più comunemente usati sono gli elettrodi immersi nelle soluzioni dei propri ioni, come gli elettrodi di argento, mercurio o idrogeno. Tuttavia, nella moderna potenziometria vengono utilizzati elettrodi a membrana ionoselettivi. Hanno alcune caratteristiche comuni, ad esempio la loro parte attiva è la membrana e la reazione ionica tra gli ioni della soluzione e la membrana determina la differenza di potenziale alla loro interfaccia. Tali elettrodi possono essere suddivisi in base alla loro struttura in vetro, membrana solida, membrana liquida e elettrodi a doppia membrana. I più usati sono gli elettrodi di vetro, che sono costituiti da un tubo di vetro terminato con un bulbo a parete sottile fatto di vetro dell’elettrodo. Ospita l’elettrodo interno, argento-cloruro d’argento immerso nella soluzione interna con un’attività costante di ioni.
