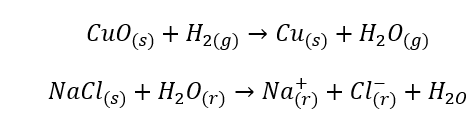Le deliberazioni su vari fenomeni e processi devono essere multistrato. Dovremmo prendere in considerazione sia le proprietà microscopiche che quelle macroscopiche. Come suggeriscono i nomi, questa divisione viene effettuata separando gli ordini di grandezza degli elementi analizzati. Il dominio macroscopico, strettamente legato alla termodinamica delle reazioni chimiche, permette di osservare e misurare proprietà fisiche e chimiche come la densità, la temperatura o la solubilità. Con l'analisi microscopica, possiamo osservare i movimenti e le interazioni delle molecole. Possiamo descrivere le molecole in termini di velocità ed energia cinetica. Se siamo interessati a una miscela, possiamo tener conto della sua omogeneità e, di conseguenza, del tipo di sistema in cui esiste.

Classificazione dei sistemi fisico-chimici
Quando si analizza l’omogeneità dei sistemi materiali, la scala macroscopica li classifica in due gruppi principali: sistemi omogenei ed eterogenei. Questa categorizzazione avviene in base alle loro caratteristiche fisiche: lo stato fisico, la solubilità e il punto di fusione, che possono differire o meno. Ogni sistema include tutte le sostanze che prendono parte a una particolare reazione o processo. La parte del sistema che si distingue nettamente mantenendo le stesse proprietà viene definita fase. Esistono tre diversi tipi di fasi: solida, liquida e gassosa. La superficie situata tra loro e il resto del sistema è chiamata interfaccia. A seconda dell’entalpia libera (ΔG) o dell’entropia (ΔS), se ΔS>0 o ΔG<0, la trasformazione di una fase in un’altra può avvenire automaticamente.
Diagramma di equilibrio di fase
Una rappresentazione grafica dell’esistenza di diverse fasi è chiamata diagramma di equilibrio di fase. Include l’esistenza di fasi specifiche (se vengono raggiunti determinati intervalli di temperatura e pressione) e le loro conversioni reciproche. Un diagramma schematico di equilibrio di fase per un sistema a un componente illustra l’esistenza di tre fasi principali a seconda delle condizioni di processo. Le linee che mostra indicano gli stati di equilibrio tra due rispettive fasi, cioè tra solido e gas, tra solido e liquido, e tra gas e liquido. Pertanto, se conosciamo uno dei parametri critici, possiamo determinare le condizioni che causeranno lo scioglimento, il congelamento, l’evaporazione, la condensazione, la sublimazione o la risublimazione dell’ingrediente in questione. Inoltre, il diagramma include un punto triplo in cui tutte le linee di fase si connettono, il che indica che tutte e tre le fasi possono coesistere in condizioni specificate. Il diagramma include anche due punti importanti: pressione critica e temperatura critica. La pressione critica è indicata dal punto che rappresenta la pressione massima alla quale possiamo convertire un liquido in un gas, o la massima pressione possibile di vapore saturo sopra il liquido. Il concetto di temperatura critica definisce la temperatura massima alla quale un gas può condensare all’aumentare della pressione. Pertanto, il punto critico esistente in condizioni critiche di temperatura e pressione definisce uno stato in cui le fasi liquida e gassosa sono impossibili da differenziare.
Regola delle fasi di Gibbs
È una relazione specifica che può essere applicata a qualsiasi sistema esistente in equilibrio termodinamico. L’equazione che rappresenta tale regola contiene il numero di fasi (f) presenti nel sistema con il numero di costituenti indipendenti (n) e il numero di gradi di libertà (s). Il numero s corrisponde alla quantità di variabili intensive regolabili che, se modificate, non disturberanno il numero di fasi nell’equilibrio del sistema isolato. Le variabili intensive sono tutti i valori fisici che non dipendono in alcun modo dal sistema (ad esempio, dimensioni geometriche o volume) o dal numero delle sue molecole, dal suo peso, dal calore specifico, ecc. L’equazione è la seguente: I componenti indipendenti del sistema , designati come n, rappresentano praticamente il minor numero di componenti del sistema necessari per costruire ciascuna delle sue fasi in qualsiasi quantità. Se analizziamo un sistema i cui componenti possono reagire tra loro, calcoliamo il valore n sottraendo il numero di equazioni di reazione indipendenti dal numero totale di componenti che formano il sistema. Pertanto, se assumiamo la seguente notazione: ![]() il numero di equazioni indipendenti è 1: esaminiamo una particolare reazione che si verifica nel sistema. Un’equazione indipendente è un qualsiasi sistema di equazioni chimiche in cui è impossibile ottenerne qualcuna combinando le altre. Mentre il numero di componenti per un tale sistema è 3: sono CaCO 3 , CaO e CO 2 . Questa informazione ci permette anche di calcolare il numero di componenti indipendenti: n = il numero di componenti – il numero di equazioni indipendenti, e quindi: n = 3 – 1 = 2 Possiamo usare lo stesso esempio per calcolare il numero di gradi di libertà utilizzando l’equazione per la regola delle fasi di Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Questo valore indica che per mantenere una quantità stabile di fasi nell’equilibrio del sistema, possiamo operare solo su una variabile intensiva.
il numero di equazioni indipendenti è 1: esaminiamo una particolare reazione che si verifica nel sistema. Un’equazione indipendente è un qualsiasi sistema di equazioni chimiche in cui è impossibile ottenerne qualcuna combinando le altre. Mentre il numero di componenti per un tale sistema è 3: sono CaCO 3 , CaO e CO 2 . Questa informazione ci permette anche di calcolare il numero di componenti indipendenti: n = il numero di componenti – il numero di equazioni indipendenti, e quindi: n = 3 – 1 = 2 Possiamo usare lo stesso esempio per calcolare il numero di gradi di libertà utilizzando l’equazione per la regola delle fasi di Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Questo valore indica che per mantenere una quantità stabile di fasi nell’equilibrio del sistema, possiamo operare solo su una variabile intensiva. 
Sistemi eterogenei
Qualsiasi sistema che includa più di una fase (quindi un sistema non omogeneo) è anche eterogeneo. La tipologia delle fasi è irrilevante; un sistema eterogeneo può contenere contemporaneamente più fasi solide e liquide ma una sola fase gassosa. Ciò è dovuto al fatto che i gas si miscelano in modo perfetto. Un esempio interessante di un sistema eterogeneo è il granito: contiene molte fasi solide, tra cui quarzo, feldspato di potassio, plagioclasio e biotite. Molti prodotti alimentari possono anche essere definiti eterogenei, esempi perfetti sono il muesli multi-ingrediente o le salse per insalata costituite da grassi, spezie e altri additivi. Un tipo interessante di miscele non omogenee sono i colloidi (soluzioni i cui costituenti possono essere distinti solo al microscopio). Tuttavia, nella maggior parte dei casi possono essere separati con metodi o strumenti semplici. Ad esempio, per separare una miscela composta da acqua e olio, possiamo utilizzare la decantazione: gli ingredienti saranno visibili ad occhio nudo. Altri metodi che possiamo utilizzare per separare efficacemente miscele non omogenee includono: filtrazione, segregazione meccanica o centrifugazione. È simile per una miscela di minerali che differiscono per proprietà: quarzo, mica e feldspato possono essere separati anche con un martello.
Sistemi omogenei
A differenza dei sistemi eterogenei, un sistema omogeneo è caratterizzato dalla presenza di una sola fase. In tal caso, non possiamo distinguere i costituenti ad occhio nudo. Anche i semplici metodi di separazione sono inefficaci e solo i metodi basati sulle caratteristiche fisiche possono rivelarsi utili. Un esempio di tale metodo è la separazione per distillazione, che si basa su punti di ebollizione diversificati di un sistema specifico. Altri metodi efficaci nella separazione di miscele omogenee sono la cristallizzazione e la cromatografia. Un tipo speciale di sistema omogeneo è una sostanza pura la cui unica fase contiene un solo componente. Un altro esempio sono tutti i tipi di soluzioni e miscele omogenee: nonostante la presenza di una sola fase, il sistema può includere molti componenti. Poiché la fase presente nel sistema può essere liquida, solida o gassosa, anche le soluzioni possono assumere tali forme. Esempi di tali sistemi sono le miscele liquide (aceto, acqua), le miscele gassose (aria atmosferica) e le miscele solide, compresi i minerali e tutti i tipi di leghe, come il bronzo o l’ottone.
Transizioni nei sistemi
Nei sistemi possono verificarsi due tipi di transizioni, essendo queste transizioni di fase (a volte chiamate fisiche) e chimiche. Le prime comprendono tutte le transizioni che non producono nuove sostanze chimiche. Non sono inoltre caratterizzati dallo sbiadimento dei componenti già presenti. Tuttavia, come indica il nome, portano a tali cambiamenti nella struttura o nello stato fisico. È anche possibile che si formi una nuova fase mentre la fase originale svanirà. Esempi di transizioni di fase includono la sublimazione e le transizioni polimorfiche di elementi. Le transizioni chimiche mostrano un meccanismo completamente diverso. Si tratta di reazioni che producono nuove sostanze che sostituiscono i costituenti originari. Tali transizioni possono essere effettuate in due varianti, per esempio durante l’idrolisi in una o più fasi così come durante la combustione.
Reazioni chimiche
- Le reazioni omogenee si verificano quando l’intero sistema, inclusi substrati e prodotti, si trova in una fase, ad esempio:
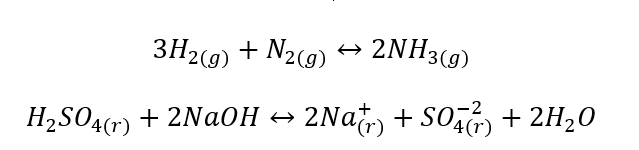
- Le reazioni eterogenee sono tali reazioni in cui il sistema, inclusi substrati e prodotti, si trova almeno in due fasi diverse. Tali reazioni si verificano sempre all’interfaccia, ad esempio: