I metodi spettroscopici sono un gruppo di metodi in cui il segnale viene prodotto dall'interazione della radiazione elettromagnetica o corpuscolare con il campione esaminato. Questa radiazione può derivare da cambiamenti periodici nel campo elettromagnetico associati al trasferimento di energia. Questi metodi vengono utilizzati per determinare la concentrazione o il contenuto di atomi in un dato sistema assorbente o emettitore. Quali tipi di spettrofotometria esistono e cosa comportano questi metodi? Questo è ciò che scoprirai dal nostro articolo.

Radiazione e transizioni energetiche
La proprietà più importante dei fotoni, o quanti di radiazione, è l’energia. La formula per il valore dell’energia (E) è il prodotto della costante di Planck (h) di 6,626·10 -34 [J ·s] e la frequenza della radiazione (v) espressa in Hertz [Hz]. 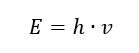 La spettrofotometria sfrutta le transizioni energetiche nelle molecole, causate dall’assorbimento o dall’emissione di radiazioni elettromagnetiche in diversi intervalli:
La spettrofotometria sfrutta le transizioni energetiche nelle molecole, causate dall’assorbimento o dall’emissione di radiazioni elettromagnetiche in diversi intervalli:
- ultravioletto (UV) 200-380 nm,
- radiazione visibile (Vis) 380-780 nm,
- vicino infrarosso (IR) 0,78-30000 μm.
Concetti base e leggi della spettrofotometria
Punto isosbestico
Questo è il punto corrispondente ad una specifica lunghezza d’onda risultante dall’intersezione delle curve tracciate nel sistema assorbanza-lunghezza d’onda, dove entrambe le forme del composto in soluzione (dissociata e indissociata) hanno uguale assorbimento. Un cambiamento nel pH non cambia la posizione, un composto può avere molti di questi punti.
Spettro di assorbimento di un composto chimico
Lo spettro è una misura della quantità di luce assorbita dal composto dalla lunghezza d’onda della luce (λ). Se una radiazione elettromagnetica (luce) di intensità I 0 cade su un campione, parte di questa radiazione verrà assorbita e parte attraverserà il campione. Registrando l’intensità della radiazione incidente (I 0 ) e trasmessa (I t ), possiamo determinare la quantità di luce che è stata assorbita dalla soluzione (assorbanza, A), o che l’ha attraversata (trasmittanza, T).
Assorbenza
La grandezza che descrive il fenomeno dell’assorbimento è l’assorbanza. Questa è una misura adimensionale dell’intensità della radiazione elettromagnetica rispetto al numero di atomi liberi. Questa figura è stata introdotta per facilitare i calcoli relativi ai volumi di assorbimento. L’assorbimento è l’interazione tra la radiazione elettromagnetica e la materia – l’assorbimento di parte dell’energia da parte della materia. L’assorbanza è additiva e viene talvolta definita densità ottica. Simbolicamente si registra come Abs o A. Matematicamente è il logaritmo decimale del rapporto tra l’intensità del fascio di radiazioni incidente sul campione (I 0 ) e l’intensità del fascio di radiazioni trasmesso attraverso il campione. ( Esso ). Può assumere valori da 0 a infinito. L’espressione matematica che descrive questa relazione è chiamata legge di Beer-Lambert. L’assorbanza a una determinata lunghezza d’onda dipende dal coefficiente di assorbimento (ε), dallo spessore dello strato assorbente (solitamente 1 cm) e dalla concentrazione della soluzione di prova.
Trasmissione
La trasmittanza è il rapporto tra l’irradianza che passa attraverso il campione (I t ) e l’irradianza incidente sul campione (I 0 ), che è uguale all’irradianza che passa attraverso il riferimento. Nella maggior parte dei casi viene espresso in percentuale e può variare dallo 0%al 100%. È espresso dalla formula: 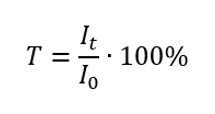 Il rapporto tra assorbanza e trasmittanza è espresso come segue:
Il rapporto tra assorbanza e trasmittanza è espresso come segue: 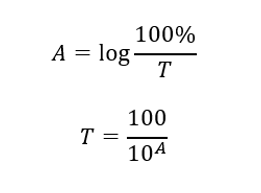
Legge Lambert
Dice che l’assorbanza è proporzionale allo spessore dello strato assorbente di un campione omogeneo. Può essere registrato come il quoziente tra il coefficiente di assorbimento (k) e lo spessore dello strato campione misurato (l): 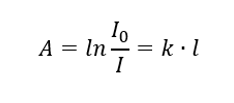

Legge di Beer-Lambert
Riguarda l’assorbimento della radiazione da parte delle soluzioni e può essere formulato come segue: se il coefficiente di assorbimento del solvente è zero, allora l’assorbanza di un fascio di radiazione monocromatico che passa attraverso una soluzione omogenea è direttamente proporzionale alla concentrazione (c) della soluzione e allo spessore dello strato assorbente (l). La legge di Beer-Lambert è la definizione di assorbanza e può essere scritta come segue: 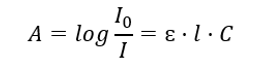 Il coefficiente di assorbimento molare (ɛ) è un valore caratteristico di una sostanza in un particolare solvente e ad una particolare lunghezza d’onda. È proporzionale alla probabilità di transizione tra i livelli energetici della molecola e dipende direttamente dall’energia dei fotoni della radiazione. In termini numerici rappresenta l’assorbanza esibita da una soluzione con concentrazione pari a 1 mol/dm 3 , con uno spessore dello strato assorbente di 1 cm. Conoscere il coefficiente consente di determinare la concentrazione della soluzione di prova dopo aver misurato l’entità dell’assorbanza. Facoltativamente, l’assorbanza prevista della soluzione può essere calcolata anche dal coefficiente e dalla concentrazione. La formula viene utilizzata principalmente per determinare la concentrazione di una sostanza con un coefficiente di assorbimento molare noto e un’assorbanza misurata empiricamente. Ciò può essere fatto utilizzando una formula o disegnando una curva di calibrazione per la sostanza in diversi punti nell’intervallo di concentrazione prevista. La legge di Beer-Lambert può anche essere presentata come dipendenza dalla concentrazione dell’assorbimento: A = f(C).
Il coefficiente di assorbimento molare (ɛ) è un valore caratteristico di una sostanza in un particolare solvente e ad una particolare lunghezza d’onda. È proporzionale alla probabilità di transizione tra i livelli energetici della molecola e dipende direttamente dall’energia dei fotoni della radiazione. In termini numerici rappresenta l’assorbanza esibita da una soluzione con concentrazione pari a 1 mol/dm 3 , con uno spessore dello strato assorbente di 1 cm. Conoscere il coefficiente consente di determinare la concentrazione della soluzione di prova dopo aver misurato l’entità dell’assorbanza. Facoltativamente, l’assorbanza prevista della soluzione può essere calcolata anche dal coefficiente e dalla concentrazione. La formula viene utilizzata principalmente per determinare la concentrazione di una sostanza con un coefficiente di assorbimento molare noto e un’assorbanza misurata empiricamente. Ciò può essere fatto utilizzando una formula o disegnando una curva di calibrazione per la sostanza in diversi punti nell’intervallo di concentrazione prevista. La legge di Beer-Lambert può anche essere presentata come dipendenza dalla concentrazione dell’assorbimento: A = f(C).
Legge di additività
La legge di Beer-Lambert si riferisce al caso in cui è presente una sostanza assorbente in soluzione. Tuttavia, se in una soluzione multicomponente sono presenti più sostanze che assorbono la radiazione ad una lunghezza d’onda selezionata, l’assorbanza di questa soluzione (A) è uguale alla somma delle assorbanze dei suoi singoli componenti (A 1 , A 2 ,…), cioè LA=LA 1 +LA 2 +⋯+LA n . Vale la pena notare e ricordare che l’assorbanza di ciascun componente è il prodotto della sua concentrazione e del corrispondente coefficiente di assorbimento molare. Questa è la terza legge dell’assorbimento, utilizzata nell’analisi spettrofotometrica di sistemi multicomponente.
Deviazioni dalle leggi di assorbimento
Un prerequisito per soddisfare le leggi dell’assorbimento è che la radiazione che agisce sul sistema sia monocromatica e che la sua intensità non sia troppo elevata. Le ragioni per deviare dalla legge Beer-Lambert possono essere:
- imperfezione degli strumenti di misura, con conseguente mancato rispetto della condizione,
- reazioni chimiche che si verificano durante la misurazione, ad esempio polimerizzazione , idrolisi, condensazione,
- torbidità della soluzione.
Applicazione degli spettri di assorbimento degli elettroni
- Consente di determinare il tipo di transizioni elettroniche esaminando gli spettri in solventi di diversa polarità.
- Le differenze nella posizione e nell’intensità delle bande di assorbimento delle diverse forme molecolari vengono utilizzate per studiare gli equilibri che si stabiliscono tra loro nella soluzione ( studi strutturali , equilibri tautomerici).
- Utilizzato per la determinazione dei composti in base alla legge Beer-Lamber.
- Utilizzato come metodo di identificazione aggiuntivo basato sulla posizione λ max delle sostanze in esame.
- Utilizzato nella determinazione della purezza dei composti di prova – spostando la posizione massima di assorbimento, confrontando il rapporto dei valori di assorbanza in due diversi punti dello spettro.

Spettroscopia elettronica UV-Vis
Per quanto riguarda il fenomeno dell’assorbimento, la spettrofotometria UV-Vis è una tecnica particolarmente interessante, che consente l’analisi qualitativa e quantitativa di numerose sostanze. Il fenomeno dell’assorbimento della radiazione viene utilizzato quando: l’assorbimento dipende linearmente dalla concentrazione oppure quando l’assorbimento è additivo, cioè per una soluzione multicomponente è la somma degli assorbimenti dei suoi componenti. Le condizioni sono soddisfatte quando non ci sono interazioni intermolecolari nel sistema. Analizzando gli spettri di assorbimento UV-Vis derivanti dal passaggio della radiazione elettromagnetica attraverso la soluzione, si osservano transizioni degli elettroni di valenza dallo stato fondamentale allo stato eccitato. Questo fenomeno comporta l’assorbimento di parte della radiazione a determinate lunghezze d’onda. L’assorbimento è la conseguenza della transizione di questi elettroni a livelli energetici più alti, ma affinché ciò avvenga i quanti di radiazione elettromagnetica devono avere energia sufficiente per bilanciare la differenza energetica tra i livelli energetici. Nelle molecole tali energie sono di pochi elettronvolt, che corrispondono esattamente alla frequenza UV-Vis.
Cromofori
I composti che presentano assorbimento nella banda dell’UV-Vis hanno nella loro struttura i cromofori, cioè gruppi di atomi i cui elettroni sono caratterizzati da basse energie di eccitazione. In altre parole, un cromoforo è la parte di una molecola (gruppo di atomi) responsabile dell’assorbimento selettivo della radiazione nel campo del visibile (180-800 nm) e quindi della comparsa del colore. Questi includono: anelli aromatici (sesteto di elettroni aromatici), legami multipli (parte di essi – legami di tipo π), sia tra atomi di carbonio che tra altri, come il gruppo carbonilico C=O.
Auxocromi
Un altro gruppo di atomi sono gli auxocromi, cioè sostituenti che non mostrano assorbimento nel campo degli UV-Vis, ma la loro presenza provoca cambiamenti negli spettri degli elementi assorbenti. Essi potenziano l’azione dei cromofori, che spesso possiamo osservare sotto forma di una colorazione della sostanza in esame molto più intensa che in caso di loro assenza nel sistema. Inoltre dividiamo gli auxocromi in batocromi , ad esempio –NH 2 , -OH, che spostano il massimo di assorbimento verso lunghezze d’onda maggiori, e ipsocromi , come –CH 3 , -CO, che spostano il massimo verso lunghezze d’onda più corte.
Spettroscopia di assorbimento atomico (AAS)
Questa è un’altra tecnica che utilizza il fenomeno dell’assorbimento. Viene utilizzato per determinare gli elementi chimici sotto forma di campioni in qualsiasi stato (liquido, solido, gas) e la misurazione stessa si basa sull’osservazione dell’assorbimento della radiazione di una lunghezza d’onda specifica da parte degli atomi metallici liberi. La base della tecnica è che un atomo può assorbire la radiazione elettromagnetica solo ad una lunghezza d’onda alla quale può anche emetterla, e questa è caratteristica solo del dato elemento. Con una maggiore energia fornita all’atomo, gli elettroni vengono eccitati a livelli più alti e nello spettro si osserva un numero maggiore di linee. Se l’energia fornita corrisponde al potenziale di ionizzazione dell’atomo si formano ioni come Na + . La base per l’analisi quantitativa mediante spettrometria di assorbimento atomico è la proporzionalità dell’assorbanza al numero di atomi assorbenti e la legge di Beer-Lambert.
