La stechiometria è la branca della chimica generale che si occupa dei calcoli riguardanti l'andamento quantitativo delle reazioni chimiche. Quando si lavora in laboratorio, molto spesso è necessario sapere quanti (massa, volume, molecole) dei substrati dobbiamo utilizzare affinché la reazione chimica che stiamo effettuando avvenga completamente oppure per ottenere la quantità di prodotto vogliamo. A volte è anche necessario calcolare il substrato in eccesso o in mancanza che ha causato uno svolgimento dell'esperimento diverso dal previsto. Ciascuno di questi calcoli deriva direttamente dall'interpretazione quantitativa dell'equazione della reazione chimica e utilizza le leggi di conservazione della massa. Questi tipi di equazioni sono chiamati calcoli stechiometrici.

Cosa dobbiamo sapere?
Per utilizzare la stechiometria, dobbiamo avere conoscenze in una serie di aree, tra cui: equazioni delle reazioni chimiche, coefficienti stechiometrici, masse molari e molari e volumi molari dei gas e legge di Avogadro . Utilizzando la conoscenza della stechiometria delle reazioni chimiche si possono risolvere molti problemi di calcolo, come ad esempio:
- analisi elementare,
- calcoli molari,
- calcoli di massa,
- calcolo di miscele non stechiometriche con possibilità di determinare la sostanza limitante nella reazione,
- resa della reazione.
Massa molare
A causa della massa inconcepibilmente piccola dei singoli atomi e molecole, è stata creata l’ unità (u) , che esprime la massa atomica. In pratica si tratta di un valore pari a 1/12 della massa dell’isotopo di carbonio 12 C. Questa porzione di sostanza è strettamente correlata alla costante di Avogadro ed è determinata come il numero di grammi di una sostanza che contiene 6.022·10 23 atomi, molecole o ioni. La massa molare [M] è numericamente uguale alla massa atomica o molecolare e l’unità è g/mol.
Volume molare della sostanza [Vm]
Questo è un valore specifico della sostanza che dipende fortemente dalle condizioni di temperatura e pressione. Questo è il volume della sostanza occupato da una mole di essa. In condizioni normali viene adottato un valore costante di 22,4 dm 3 .
Legge di composizione costante e conservazione della massa
Ogni composto chimico, indipendentemente dalla sua origine e dal metodo per ottenerlo, ha una composizione qualitativa e quantitativa ben definita e costante. L’ossido di zolfo (IV), ad esempio, contiene sempre il 50%in peso di zolfo e l’ossido di zolfo (VI) il 40%in peso di questo elemento. In un sistema chiuso, la massa dei prodotti risultanti è uguale alla massa dei substrati consumati durante la reazione. La legge di conservazione della massa si riflette nella necessità di bilanciare ciascuna equazione di reazione chimica con i coefficienti chimici appropriati in modo che i due membri dell’equazione siano uguali in termini di numero di atomi presenti. I rapporti stechiometrici riflettono i rapporti molari dei reagenti presenti nella reazione chimica.
Equazione della reazione chimica
Tutte le informazioni necessarie sulle relazioni relative tra le sostanze chimiche derivano dalla loro equazione di reazione chimica. Fornisce alcune importanti informazioni relative e quantitative.
Esempio 1.
Dall’equazione per la sintesi dell’ammoniaca , che segue la reazione: ![]() possiamo eseguire diverse interpretazioni: molecolare, molare, masse molari, volumi molari e numeri molecolari. a) Molecolarmente possiamo leggere che tre molecole di idrogeno reagiscono con una molecola di azoto per formare due molecole di ammoniaca. b) Ciò significa anche che tre moli di idrogeno reagiscono con una mole di azoto per formare il prodotto di due moli di ammoniaca. c) Utilizzando la tavola periodica degli elementi chimici , che contiene le masse molari dei singoli atomi, possiamo anche concludere dall’equazione che 6 g di idrogeno hanno reagito completamente con 28 g di azoto per formare 34 g di ammoniaca. d) Allora, assumendo condizioni normali, sappiamo che una mole di gas occupa 22,4 dm 3 . Ciò ci permette di concludere che 67,2 dm 3 di idrogeno reagiscono con 22,4 dm 3 di azoto per formare 44,8 dm 3 di ammoniaca. e) Un’altra relazione utile è la legge di Avogadro, la quale afferma che volumi uguali di gas diversi contengono lo stesso numero di particelle nelle stesse condizioni di pressione e temperatura. Conoscendo la costante di Avogadro di 6.022·10 23 , sappiamo che abbiamo bisogno di 3·6.022·10 23 molecole di idrogeno e 6.022·10 23 molecole di azoto per effettuare la reazione chimica completa per la sintesi dell’ammoniaca. La reazione produce 2·6.022·10 23 molecole di ammoniaca.
possiamo eseguire diverse interpretazioni: molecolare, molare, masse molari, volumi molari e numeri molecolari. a) Molecolarmente possiamo leggere che tre molecole di idrogeno reagiscono con una molecola di azoto per formare due molecole di ammoniaca. b) Ciò significa anche che tre moli di idrogeno reagiscono con una mole di azoto per formare il prodotto di due moli di ammoniaca. c) Utilizzando la tavola periodica degli elementi chimici , che contiene le masse molari dei singoli atomi, possiamo anche concludere dall’equazione che 6 g di idrogeno hanno reagito completamente con 28 g di azoto per formare 34 g di ammoniaca. d) Allora, assumendo condizioni normali, sappiamo che una mole di gas occupa 22,4 dm 3 . Ciò ci permette di concludere che 67,2 dm 3 di idrogeno reagiscono con 22,4 dm 3 di azoto per formare 44,8 dm 3 di ammoniaca. e) Un’altra relazione utile è la legge di Avogadro, la quale afferma che volumi uguali di gas diversi contengono lo stesso numero di particelle nelle stesse condizioni di pressione e temperatura. Conoscendo la costante di Avogadro di 6.022·10 23 , sappiamo che abbiamo bisogno di 3·6.022·10 23 molecole di idrogeno e 6.022·10 23 molecole di azoto per effettuare la reazione chimica completa per la sintesi dell’ammoniaca. La reazione produce 2·6.022·10 23 molecole di ammoniaca.
Esempio 2.
La reazione di combustione del magnesio nel cloro avviene secondo l’equazione: ![]() ci permette di arrivare a interpretazioni simili all’esempio precedente. a) Già a prima vista, l’equazione presentata ci permette di concludere che, per ottenere una molecola di cloruro di magnesio , dobbiamo fornire come substrati una molecola di magnesio e una molecola di cloro. b) Questo equivale ovviamente al numero di moli presenti nel sistema, cioè una mole di magnesio, una mole di cloro, una mole di cloruro di magnesio. c) Per i calcoli della massa, sappiamo che 24 g di magnesio reagiscono con 71 g di cloro per formare 95 g di cloruro di magnesio. d) Poiché nella reazione chimica in esame interviene un solo gas, il cloro , possiamo anche scrivere per esso che occupa un volume di 22,4 dm 3 . e) Nei conteggi delle particelle ogni componente è uguale all’altro e assume il valore 6.022·10 23 .
ci permette di arrivare a interpretazioni simili all’esempio precedente. a) Già a prima vista, l’equazione presentata ci permette di concludere che, per ottenere una molecola di cloruro di magnesio , dobbiamo fornire come substrati una molecola di magnesio e una molecola di cloro. b) Questo equivale ovviamente al numero di moli presenti nel sistema, cioè una mole di magnesio, una mole di cloro, una mole di cloruro di magnesio. c) Per i calcoli della massa, sappiamo che 24 g di magnesio reagiscono con 71 g di cloro per formare 95 g di cloruro di magnesio. d) Poiché nella reazione chimica in esame interviene un solo gas, il cloro , possiamo anche scrivere per esso che occupa un volume di 22,4 dm 3 . e) Nei conteggi delle particelle ogni componente è uguale all’altro e assume il valore 6.022·10 23 . 
Resa percentuale della reazione chimica [ %W]
I calcoli stechiometrici vengono utilizzati anche per conoscere la resa di una reazione, cioè il rapporto tra la quantità effettiva di prodotto ottenuto e la quantità derivata dall’equazione della reazione chimica.
Esempio 1.
È stata condotta la reazione di ossidazione di 30 kg di ossido di zolfo (IV) e, in presenza di un catalizzatore al platino, il prodotto ottenuto è stato di 34 kg di ossido di zolfo (VI). Con quale è stata la resa di questo processo? Equazione della reazione chimica: ![]() Dalla reazione registrata, possiamo vedere che due moli di ossido di zolfo (IV) producono la stessa quantità di moli di ossido di zolfo (VI). Conoscendo le masse molari dei reagenti, sappiamo che stechiometricamente, assumendo una resa del 100%, 128 g di SO 2 producono 160 g di SO 3 . Con questa conoscenza, possiamo organizzare il rapporto: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Da qui scopriremo la quantità di ossido di zolfo (VI) che verrebbe prodotta al 100%prodotto.
Dalla reazione registrata, possiamo vedere che due moli di ossido di zolfo (IV) producono la stessa quantità di moli di ossido di zolfo (VI). Conoscendo le masse molari dei reagenti, sappiamo che stechiometricamente, assumendo una resa del 100%, 128 g di SO 2 producono 160 g di SO 3 . Con questa conoscenza, possiamo organizzare il rapporto: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Da qui scopriremo la quantità di ossido di zolfo (VI) che verrebbe prodotta al 100%prodotto. 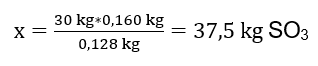 Conoscendo la quantità teorica ed effettiva di SO 3 possiamo calcolare la resa alla quale è avvenuta la reazione. 37,5 kg SO 3 – resa 100%34 kg SO 3 – resa x%.
Conoscendo la quantità teorica ed effettiva di SO 3 possiamo calcolare la resa alla quale è avvenuta la reazione. 37,5 kg SO 3 – resa 100%34 kg SO 3 – resa x%. 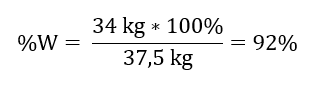 L’ossidazione dell’ossido di zolfo (IV) in ossido di zolfo (VI) utilizzando un catalizzatore al platino è avvenuta con una resa del 92%.
L’ossidazione dell’ossido di zolfo (IV) in ossido di zolfo (VI) utilizzando un catalizzatore al platino è avvenuta con una resa del 92%.
Formule molecolari ed elementari
Un’altra applicazione dei calcoli stechiometrici è determinare le formule di composti chimici semplici. La formula molecolare di un composto chimico è identica o un multiplo intero della formula empirica. Se sappiamo che la formula generale di un composto chimico è N x O y , i valori degli indici stechiometrici possono essere calcolati dividendo la massa degli atomi per le loro masse atomiche. Se di un composto chimico non si conosce il peso molecolare, ma solo la sua composizione percentuale, si può fornire solo la formula elementare. Può essere una rappresentazione fedele della formula molecolare o semplicemente determinare il rapporto dei singoli elementi.
Esempio 1.
Il peso molecolare del composto chimico è 92 u ed è costituito dal 30,43 %di azoto e dal 69,57 %di ossigeno. Qual è la formula molecolare del composto chimico? Poiché la somma delle molecole presenti nel composto è 100%possiamo assumere che: 92 u – 100%Questo ci permette di calcolare i singoli contenuti elementari: 92 u – 100%xu di azoto – 30,43%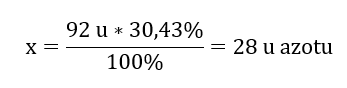 Sappiamo quindi che la massa per atomo di ossigeno è: 92 u – 28 u = 64 u Conoscendo le singole masse degli elementi possiamo determinare gli indici stechiometrici:
Sappiamo quindi che la massa per atomo di ossigeno è: 92 u – 28 u = 64 u Conoscendo le singole masse degli elementi possiamo determinare gli indici stechiometrici: 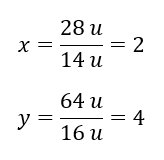 La formula molecolare di questo composto chimico è N 2 O 4 .
La formula molecolare di questo composto chimico è N 2 O 4 .
Esempio 2.
Ci sono due elementi nel composto chimico: ossigeno al 60%e zolfo al 40%. Qual è la sua formula elementare? La formula generale è S x O y , dove x è 40%e y è 60%. Conoscendo le masse molari dei singoli elementi, questo può essere rappresentato come segue: 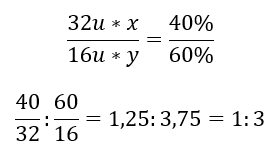 Ciò significa che in un dato composto chimico ci sono tre atomi di ossigeno per ogni atomo di zolfo. La formula elementare è SO 3 .
Ciò significa che in un dato composto chimico ci sono tre atomi di ossigeno per ogni atomo di zolfo. La formula elementare è SO 3 . 
Substrato in eccesso e limitante
Nel caso di reazioni in cui i reagenti sono presenti in rapporti divergenti dalla loro corrispondente stechiometria, uno dei reagenti reagirà completamente e la reazione si fermerà. Esso è quindi presente sotto forma di reagente limitante, mentre il secondo reagente sarà nel sistema in eccesso e sarà anch’esso ancora presente nel sistema nella sua forma primaria quando la reazione sarà completa.
Esempio 1.
In laboratorio, 40 cm 3 di una soluzione di solfato di alluminio 0,25 M sono stati fatti reagire con 50 cm 3 di una soluzione di cloruro di bario 0,5 M. Quanti grammi di precipitato si formeranno? Equazione della reazione chimica: ![]() Il primo passo per conoscere il corso effettivo di una reazione è determinare il numero effettivo di moli delle sostanze coinvolte nella reazione. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol Il secondo passaggio è per determinare il substrato deficitario in base alla stechiometria della reazione: ciò determinerà la quantità di precipitato formato. 1 mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
Il primo passo per conoscere il corso effettivo di una reazione è determinare il numero effettivo di moli delle sostanze coinvolte nella reazione. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol Il secondo passaggio è per determinare il substrato deficitario in base alla stechiometria della reazione: ciò determinerà la quantità di precipitato formato. 1 mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 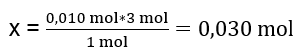 Per effettuare la reazione completamente, avendo 0,010 moli di Al 2 (SO 4 ) 3 , è necessario aggiungere al sistema 0,030 moli di BaCl 2 . Tuttavia, reagiscono solo 0,025 moli di cloruro di bario, il che significa che è in deficit e limiterà la reazione. Pertanto, la quantità di precipitato formato nella reazione deve essere calcolata dalla quantità di questo substrato. Il numero di moli di cloruro di bario utilizzato secondo la stechiometria della reazione è pari al numero di moli del precipitato formatosi, quindi: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Conoscendo il numero di moli di bario solfato, possiamo calcolare la sua massa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025 mol · 233,393 g/mol = 5,835 g Le reazioni e le quantità di substrati indicate nell’attività producono 5,835 g di precipitato di solfato di bario.
Per effettuare la reazione completamente, avendo 0,010 moli di Al 2 (SO 4 ) 3 , è necessario aggiungere al sistema 0,030 moli di BaCl 2 . Tuttavia, reagiscono solo 0,025 moli di cloruro di bario, il che significa che è in deficit e limiterà la reazione. Pertanto, la quantità di precipitato formato nella reazione deve essere calcolata dalla quantità di questo substrato. Il numero di moli di cloruro di bario utilizzato secondo la stechiometria della reazione è pari al numero di moli del precipitato formatosi, quindi: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Conoscendo il numero di moli di bario solfato, possiamo calcolare la sua massa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025 mol · 233,393 g/mol = 5,835 g Le reazioni e le quantità di substrati indicate nell’attività producono 5,835 g di precipitato di solfato di bario.
