화학적 맥락에서 해리는 물질이 다른 분자로 분해되는 것을 의미합니다. 이 단어는 "분리"를 의미하는 라틴어 " dissociatio "에서 유래되었습니다. 과학적 명명법에서 해리는 심리학에서도 특정한 의미를 갖기 때문에 다양한 정의를 가지고 있습니다. 그러나 화학에서 해리가 무엇을 의미하는지에 초점을 맞추겠습니다. 과정의 과정과 사용된 물질에 따라 해리의 네 가지 유형을 구분할 수 있습니다. 열해리도 마찬가지로 중요하지만 가장 널리 사용되는 방법은 전해해리입니다.

열 해리
이 과정은 온도의 영향 하에서 분자를 더 작은 분자 또는 원자로 분해하는 것으로 구성됩니다. 가장 중요한 관계는 화합물이 약한 화학 결합을 포함하는 경우 해리에 사용되는 온도가 더 낮을 수 있다는 사실입니다. 분해에 필요한 에너지가 높을수록 더 높은 온도가 필요합니다. 열분해(열 해리)의 일반적인 예는 160 o C에서 발생하는 자당의 캐러멜화입니다.
전해 해리
스웨덴 화학자 Svante Arrhenius가 1887년에 발견한 열 해리에 비해 다소 복잡합니다. 전해 해리는 용매(일반적으로 물)가 자유롭게 움직이는 이온에 영향을 미칠 때 발생하는 물질의 분해로 구성됩니다. Arrhenius는 그의 연구에서 그러한 해리에 의해 생성된 이온이 용액이 전기를 전도하게 한다는 것을 증명했습니다. 이는 화학물질을 전해질(전류를 통할 수 있는 용액)과 비전해질(전류를 통할 수 없는 용액)으로 분류하는 기초가 되었습니다.
전해질
"전해질"이라는 용어에는 두 가지 의미가 있습니다. 기술적인 관점에서 볼 때 전극 사이에서 전하를 이온적으로 전달할 수 있는 모든 물질입니다. 결과적으로 전류를 이온적으로 전도할 수 있습니다. 이 용어의 다른 화학적 의미는 용융 또는 용해의 결과로 전해 해리되는 물질을 의미합니다. 이러한 용액(대부분 수성)도 전기를 전도합니다. 그러한 전해질의 예는 염화나트륨(테이블 염)과 같은 이온성 화합물뿐만 아니라 염산 또는 수산화칼륨 과 같은 비이온성 화합물을 포함한다. 특정 특성을 감안할 때 전해질은 전기 전도체라고 부를 수 있습니다. 이들은 1급 전도체(금속, 그 합금 및 탄소)와 2급 전도체(염기, 산 및 염의 용액)로 나눌 수 있습니다.
전해 해리의 메커니즘
유전 상수가 높은 용매(예: 물의 경우 81)에서는 결정 네트워크에서 이온 간의 상호 인력이 상당히 감소합니다. 이것은 이온이 끊어질 때 물질이 용해되고 용액으로 자유롭게 움직이는 이온을 분비하게 합니다. 이러한 과정은 또한 H 2 O의 극성 구조의 결과인 이온과 물 분자 사이의 상호 작용으로 인해 발생합니다. Nekrasov에 따르면 이온 구조를 가진 전해질이 분해되는 동안 물의 작용 메커니즘은 다음과 같이 시작됩니다. 물 분자의 반대 극을 끌어 당기는 동시에 양이온을 밀어내는 물질의 양이온. 반대 극도 같은 방식으로 작용하고 두 이온 모두 끌어당긴 물 분자에 의해 둘러싸입니다. 이러한 인력은 쌍극자 분자와 이온 사이의 양방향에서 발생하며, 이로 인해 전해질에서 이온의 인력이 훨씬 낮아집니다. 따라서 메커니즘은 극성에서 이온 구조로의 전이, 이온 구조의 형성 및 이온의 수화라는 네 가지 주요 단계로 나눌 수 있습니다. 해리에 의해 생성된 이온과 용매 사이의 연결을 용매화물이라고 합니다. 물이 용매이면 수화물이라고 합니다.
수화 껍질
그것은 반대 극을 향하여 이온의 가장 가까운 곳에 존재하는 물 분자로 구성된 껍질입니다. 자유 하전된 극은 이온의 인력이 용액의 분자 운동 에너지보다 약해질 때까지 더 많은 수층을 끌어당깁니다. 쉘은 전해질 분자가 양이온과 음이온으로 분해되는 것을 촉진하고, 분자를 형성하기 위한 이온의 재연결을 방해하는 장벽을 구성합니다. 
산과 염기의 해리: 대량 작용의 법칙
강산은 수용액에서 광범위한 해리를 나타내는 산이고, 약산은 아주 약간만 해리되는 산이다. 서로 다른 산의 강도를 비교하는 경우 산 분자가 양성자를 내놓는 경향이나 해당 물질의 농도와 같은 몇 가지 요인도 고려해야 합니다. 그러나 농도에 의존하지 않고 분자의 개별 특성을 탁월하게 특성화하는 화학적 값인 해리 상수가 있습니다. 해당 값에 대한 방정식 유도는 산 해리 에 대한 방정식을 작성하여 시작해야 합니다. 단일 양성자(HX)가 있는 예의 경우 다음과 같습니다. ![]() 용액이 희석되고 산이 약하면 다음과 같이 표현되는 질량 작용의 법칙을 적용할 수 있습니다.
용액이 희석되고 산이 약하면 다음과 같이 표현되는 질량 작용의 법칙을 적용할 수 있습니다. 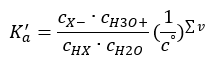 제시된 관계를 더 짧게 만드는 두 가지 방법이 있습니다. 첫 번째 단계는 물의 농도가 일정하다고 가정하는 것입니다. 1 mol/dm 3 과 같은 표준 농도를 나타내므로 co 기호를 생략할 수도 있습니다. 그러나 초기 공식에 배치하고 단위를 결정할 때 고려하는 것이 중요합니다. 화학 상수는 차원이 없는 값이기 때문입니다. 한편, 공식에 사용된 모든 농도는 mol/dm 3 로 표시됩니다. 그런 다음 최종적으로 해리 상수에 대한 공식을 얻습니다.
제시된 관계를 더 짧게 만드는 두 가지 방법이 있습니다. 첫 번째 단계는 물의 농도가 일정하다고 가정하는 것입니다. 1 mol/dm 3 과 같은 표준 농도를 나타내므로 co 기호를 생략할 수도 있습니다. 그러나 초기 공식에 배치하고 단위를 결정할 때 고려하는 것이 중요합니다. 화학 상수는 차원이 없는 값이기 때문입니다. 한편, 공식에 사용된 모든 농도는 mol/dm 3 로 표시됩니다. 그런 다음 최종적으로 해리 상수에 대한 공식을 얻습니다. 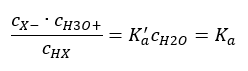 산해리 상수(K a )를 나타내는 관계는 실험에 의해 결정된 값으로 구성되며 10 -10 ~ 10 8 범위에 속합니다. 널리 사용되는 연산은 pK a 로 지정된 해리 상수의 음의 로그로 표현되는 대수 공식을 사용하는 것입니다. pK a = -logK a 낮은 K a 값은 약산을 나타내고 높은 값은 강산을 나타내는 것이 중요합니다. , pK a 는 반대 방향으로 변경됩니다. 낮은, 일반적으로 음의 pK a 값은 강산에 해당합니다. 양의 높은 pK a 값은 약산을 나타냅니다. 또 다른 개념을 소개하면, 해리도(α)는 주어진 화합물이 해리(이온으로 분해)되는 분자의 총 몰수에 대한 분자의 몰수의 비율이다. 솔루션에 존재하는 그 화합물, 우리는 방정식을 더 발전시킬 수 있습니다. 물 해리에 의해 형성된 매우 낮은 농도의 수소 이온을 무시하고 이온과 분자의 평형 농도를 사용하면 다음과 같이 가정할 수 있습니다.
산해리 상수(K a )를 나타내는 관계는 실험에 의해 결정된 값으로 구성되며 10 -10 ~ 10 8 범위에 속합니다. 널리 사용되는 연산은 pK a 로 지정된 해리 상수의 음의 로그로 표현되는 대수 공식을 사용하는 것입니다. pK a = -logK a 낮은 K a 값은 약산을 나타내고 높은 값은 강산을 나타내는 것이 중요합니다. , pK a 는 반대 방향으로 변경됩니다. 낮은, 일반적으로 음의 pK a 값은 강산에 해당합니다. 양의 높은 pK a 값은 약산을 나타냅니다. 또 다른 개념을 소개하면, 해리도(α)는 주어진 화합물이 해리(이온으로 분해)되는 분자의 총 몰수에 대한 분자의 몰수의 비율이다. 솔루션에 존재하는 그 화합물, 우리는 방정식을 더 발전시킬 수 있습니다. 물 해리에 의해 형성된 매우 낮은 농도의 수소 이온을 무시하고 이온과 분자의 평형 농도를 사용하면 다음과 같이 가정할 수 있습니다. 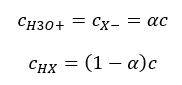 그런 다음 해리 상수는 다음과 같이 기록할 수 있습니다.
그런 다음 해리 상수는 다음과 같이 기록할 수 있습니다.  이 형태에서 그것은 농도, 즉 Ostwald의 희석 법칙에서 전해질의 해리 정도의 의존성입니다. 매우 약한 전해질을 분석하면 해리도(α)는 <<1로 가정할 수 있으며 공식은 다음과 같이 단순화할 수 있습니다.
이 형태에서 그것은 농도, 즉 Ostwald의 희석 법칙에서 전해질의 해리 정도의 의존성입니다. 매우 약한 전해질을 분석하면 해리도(α)는 <<1로 가정할 수 있으며 공식은 다음과 같이 단순화할 수 있습니다.  하나 이상의 양성자를 포함하는 산은 다단계 해리를 거치며 모든 단계를 고려해야 합니다. 예를 들어 오르토인산의 경우 세 단계가 있습니다.
하나 이상의 양성자를 포함하는 산은 다단계 해리를 거치며 모든 단계를 고려해야 합니다. 예를 들어 오르토인산의 경우 세 단계가 있습니다.
- H3PO4 + H2O = H2PO4 – + H3O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO42- + H2O = PO43- + H3O +
각 단계에는 자체 평형 상수가 있으며 첫 번째 단계와 유사하게 표시할 수 있습니다.  수산산과 산소산 모두에 대한 해리 상수가 표로 작성됩니다.
수산산과 산소산 모두에 대한 해리 상수가 표로 작성됩니다.
| 산 | 카 | pKa |
| HF | 6,3·10 -4 | 3.2 |
| 염산 | 1·10 7 | -7 |
| HNO3 | 27.54 | -1.44 |
| H3PO4 _ | 6.9·10 -3 | 2.16 |
표 1. 산에 대한 해리 상수 값의 예. 해리 중 염기 평형의 안정화와 유사합니다. 예제 규칙 B를 고려하면 방정식은 다음과 같이 표시될 수 있습니다. ![]() 그런 다음 질량 작용 법칙을 사용하고 희석된 용액의 물 농도가 거의 일정하다고 가정하여 염기에 대한 해리 상수를 유도하려는 경우 다음 공식을 얻습니다.
그런 다음 질량 작용 법칙을 사용하고 희석된 용액의 물 농도가 거의 일정하다고 가정하여 염기에 대한 해리 상수를 유도하려는 경우 다음 공식을 얻습니다.  염기가 강할수록 해리 상수가 높고 pK b 값이 낮고, 해리 상수가 낮고 pK b 값이 높을수록 염기가 약합니다.
염기가 강할수록 해리 상수가 높고 pK b 값이 낮고, 해리 상수가 낮고 pK b 값이 높을수록 염기가 약합니다.
| 베이스 | 케이비 | pKb |
| 히드라진 | 3·10 -6 | 5.5 |
| 암모니아 | 1.78·10 -5 | 4.75 |
| 메틸아민 | 5.0·10 -4 | 3.3 |
표 2. 염기에 대한 해리 상수 값의 예. 
산의 강도를 결정하는 요인
특정 산에 대한 해리 상수의 표현을 알고 있다면 몇 가지 진정한 가정을 할 수 있습니다.
- 수소산의 강도는 수소 원자와 연결된 원소의 원자 번호가 증가함에 따라 증가합니다.
- 수소산의 강도는 수소 원자에 부착된 원소의 전기음성도가 증가함에 따라 감소합니다. 이것은 이론적으로 증가하는 전기음성도가 양성자의 추상화에 유리해야 하기 때문에 오해의 소지가 있을 수 있습니다.
- 해리 동안 형성된 음이온의 크기는 전기 음성도보다 해리 상수에 더 큰 영향을 미칩니다.
물의 자기 해리
해리의 흥미로운 예는 물 분자의 분해입니다. 양성자를 끌어당길 수도 있고 내보낼 수도 있기 때문에 순수한 물은 다음 방정식에 따라 약간의 자기 해리를 겪습니다. H 2 O + H 2 O ↔ H 3 O + + OH – 산과 마찬가지로 염기의 경우, 음이온과 양이온뿐만 아니라 해리되지 않은 물의 평형 농도를 포함하는 질량 작용 법칙을 적용하는 것도 가능합니다. 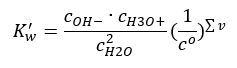 H 3 O + 양이온과 OH – 음이온의 농도는 비 해리 물에 비해 너무 작아서 그들의 변화가 비 해리 물의 농도를 실질적으로 변화시키지 않는다는 것이 밝혀졌습니다. 이를 통해 값이 일정하다고 가정하고 방정식을 다음 형식으로 변환할 수 있습니다. K w = c OH – · c H3O + 화학 계산의 맥락에서 특히 중요한 측면이며 이러한 상수는 참조됩니다. 물의 이온 생성물로. pK w 로 지정된 음의 로그로도 자주 사용됩니다. 이는 –logK w 와 같습니다. 방정식에 따라 H 3 O + 이온 공급으로 인해 물의 이온 평형이 방해받는 경우 이온 생성물의 일정성을 유지하기 위해 OH – 이온의 농도를 줄여야합니다. 마찬가지로 과량의 OH-이온 은 양이온의 농도를 감소시킵니다. 이러한 농도의 곱은 일정해야 합니다. 실험은 298K 의 온도에서 Kw 가 10-14임을 보여주었다. 따라서 순수한 물에 유효한 방정식은 다음과 같습니다.
H 3 O + 양이온과 OH – 음이온의 농도는 비 해리 물에 비해 너무 작아서 그들의 변화가 비 해리 물의 농도를 실질적으로 변화시키지 않는다는 것이 밝혀졌습니다. 이를 통해 값이 일정하다고 가정하고 방정식을 다음 형식으로 변환할 수 있습니다. K w = c OH – · c H3O + 화학 계산의 맥락에서 특히 중요한 측면이며 이러한 상수는 참조됩니다. 물의 이온 생성물로. pK w 로 지정된 음의 로그로도 자주 사용됩니다. 이는 –logK w 와 같습니다. 방정식에 따라 H 3 O + 이온 공급으로 인해 물의 이온 평형이 방해받는 경우 이온 생성물의 일정성을 유지하기 위해 OH – 이온의 농도를 줄여야합니다. 마찬가지로 과량의 OH-이온 은 양이온의 농도를 감소시킵니다. 이러한 농도의 곱은 일정해야 합니다. 실험은 298K 의 온도에서 Kw 가 10-14임을 보여주었다. 따라서 순수한 물에 유효한 방정식은 다음과 같습니다.  해리는 용액의 pH 값과도 관련이 있습니다. 동일한 농도의 H 3 O + 양이온 및 OH – 음이온을 갖는 용액은 중성 pH를 나타냅니다. 산성 용액에서 양이온의 농도는 10 -7 mol/l보다 높고 알칼리성 용액에서는 10 -7 mol/l보다 낮습니다.
해리는 용액의 pH 값과도 관련이 있습니다. 동일한 농도의 H 3 O + 양이온 및 OH – 음이온을 갖는 용액은 중성 pH를 나타냅니다. 산성 용액에서 양이온의 농도는 10 -7 mol/l보다 높고 알칼리성 용액에서는 10 -7 mol/l보다 낮습니다.
