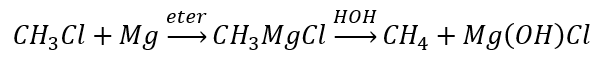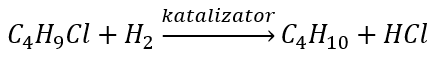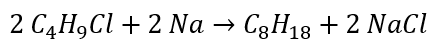화학 구조의 관점에서 알칸은 탄화수소 그룹에 속합니다. 이 화합물은 탄소와 수소의 두 가지 유형의 원자만 포함합니다. 그들은 수소 원자와 연결된 기본 탄소 골격으로 구성됩니다. 알케인은 단일 결합만을 가지고 있기 때문에 포화 탄화수소라고 합니다.

상동 시리즈
그들의 구조에서 증가하는 양의 수소 원자에 의해 배열된 알칸 대표는 상동 계열을 형성합니다. 그것은 하나의 탄소 원자를 포함하는 메탄으로 시작하여 9개의 탄소 원자를 포함하는 데칸으로 끝납니다. 알칸의 이름은 구조에 존재하는 탄소 원자의 양에서 유래하며 그리스 또는 라틴 숫자뿐만 아니라 헵탄, 노난 등의 특징적인 -ane 끝으로 정의됩니다. 알칸의 일반 공식은 다음과 같습니다. , 여기서 ‘n’은 사슬에 존재하는 탄소(C) 수를 나타내고 ‘H’는 수소 원자를 나타냅니다.
| 사슬에 존재하는 탄소 원자의 수 | 알칸 공식 | 알칸 이름 |
| 1 | 채널 4 | 메탄 |
| 2 | C2H6 _ | 에탄 |
| 삼 | C3H8 _ | 프로판 |
| 4 | 씨 4 시 10분 | 부탄 |
| 5 | C5H12 _ | 펜탄 |
| 6 | 6 시간 14분 | 헥산 |
| 7 | C7H16 _ | 헵탄 |
| 8 | 시 8 시 18분 | 옥탄 |
| 9 | 9 시간 20분 | 노난 |
| 10 | 씨 10 시 22분 | 데칸 |
포화 탄화수소의 종류
사슬 구조 측면에서 다음 유형의 알칸을 구별합니다.
-
선형(파라핀) 알칸
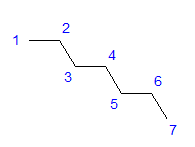 그림 1 헵탄의 구조식 모든 탄소 원자는 sp 3 혼성화를 나타냅니다. 결합 사이의 정사각형 각도로 인해 지그재그 모양의 탄소 원자 배열이 필요합니다. 탄소 원자 사이의 단일 결합 주위에서 자유 회전이 가능하기 때문에 분자는 다양한 배열을 취할 수 있습니다. 구조의 탄소 수가 높을수록 사슬 모양이 더 다양할 수 있습니다.
그림 1 헵탄의 구조식 모든 탄소 원자는 sp 3 혼성화를 나타냅니다. 결합 사이의 정사각형 각도로 인해 지그재그 모양의 탄소 원자 배열이 필요합니다. 탄소 원자 사이의 단일 결합 주위에서 자유 회전이 가능하기 때문에 분자는 다양한 배열을 취할 수 있습니다. 구조의 탄소 수가 높을수록 사슬 모양이 더 다양할 수 있습니다.
-
이소알케인: 분지형 포화 탄화수소
분지형 탄화수소의 형성은 탄소 원자와 둘 이상의 다른 탄소 원자 사이의 연결 효과입니다. 이러한 링크 지점에 분기가 형성됩니다. 분지형 탄화수소는 선형 탄화수소 이성질체입니다. 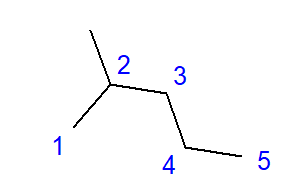 그림 2 2-메틸펜탄의 구조식 그림 2에 표시된 2-메틸펜탄의 구조식은 총 6개의 탄소 원자를 가지며 헥산 이성질체입니다. ‘2-메틸펜탄’이라는 이름은 펜탄 사슬이 두 번째 탄소 원자의 위치에 연결된 메틸기를 가지고 있음을 의미합니다. 가능한 구조 이성질체의 수는 탄소 수가 증가함에 따라 증가합니다. 예를 들어, 헥산은 5가지 이성질체의 구조를 가질 수 있고, 옥탄은 18가지 가능성이 있으며, 헥산은 75가지가 될 수 있습니다.
그림 2 2-메틸펜탄의 구조식 그림 2에 표시된 2-메틸펜탄의 구조식은 총 6개의 탄소 원자를 가지며 헥산 이성질체입니다. ‘2-메틸펜탄’이라는 이름은 펜탄 사슬이 두 번째 탄소 원자의 위치에 연결된 메틸기를 가지고 있음을 의미합니다. 가능한 구조 이성질체의 수는 탄소 수가 증가함에 따라 증가합니다. 예를 들어, 헥산은 5가지 이성질체의 구조를 가질 수 있고, 옥탄은 18가지 가능성이 있으며, 헥산은 75가지가 될 수 있습니다.
-
고리형 탄화수소: 시클로알칸, 지환식 탄화수소
반복되는 -CH 2 – 원소로 구성된 고리를 형성하면서 사슬 구조를 닫을 수 있습니다. 이름은 cyclobutane 또는 cycloheptane과 같이 접두사 ‘cyclo-‘가 붙은 알칸의 이름을 기반으로 합니다. 쉽게 하기 위해 일반 다각형으로 표시할 수 있습니다. 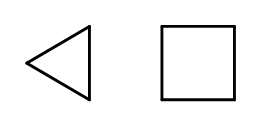 그림 3 왼쪽부터: 시클로프로판, 시클로부탄 이름에 치환기가 포함된 치환 고리도 있습니다. 이 경우 탄소 원자의 수는 치환기의 위치가 가능한 낮게 설계됩니다.
그림 3 왼쪽부터: 시클로프로판, 시클로부탄 이름에 치환기가 포함된 치환 고리도 있습니다. 이 경우 탄소 원자의 수는 치환기의 위치가 가능한 낮게 설계됩니다.
가장 중요한 대표자
메탄은 분자식 CH 4 를 갖는 화합물로 알칸의 상동 시리즈를 시작합니다. 탄소는 4가이므로 4개의 CH 결합을 가지고 있습니다. 상온에서는 무취, 무색의 기체입니다. 탄소 원자는 sp 3 혼성화를 나타내어 사면체 구조를 가지며 생성된 오비탈은 4개의 수소 원자와 함께 등가 결합을 형성한다. 에탄은 분자식이 C 2 H 6 인 시리즈의 다음 알칸입니다. 반구조식 H 3 C-CH 3 를 보면 각 탄소 원자가 3개의 수소 원자와 연결되어 있음을 알 수 있습니다. 메탄 및 기타 저급 탄화수소와 마찬가지로 무색 및 무취 가스입니다. CH 결합은 전면 시그마 sp-s 결합인 반면 탄소 원자 사이의 단일 결합은 전면 시그마 sp-sp 결합입니다.
알칸의 합성
알데히드와 케톤의 감소
- 클레멘센 감소
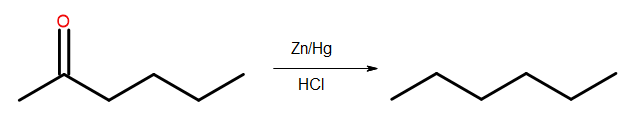 그림 4 Clemmensen 환원 다이어그램
그림 4 Clemmensen 환원 다이어그램
- Wolff-Kishner 반응
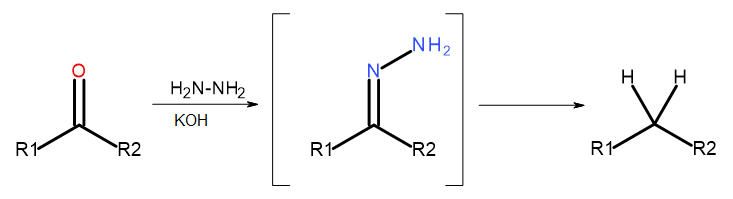 그림 5 Wolff-Kishner 다이어그램
그림 5 Wolff-Kishner 다이어그램
알칸의 물리화학적 성질
실온에서 C1에서 C4 까지의 단쇄 알칸은 기체입니다. 다른 동족체(펜탄에서 시작)는 끓는점이 증가하는 액체입니다. 구조에 존재하는 가지로 인해 이성질체의 끓는점이 낮아집니다. 구조에 또 다른 –CH 2 – 그룹을 추가하는 의존성은 탄소 사슬의 길이 증가와 함께 끓는점을 약 20–30 o C 더 높입니다. n-octadecane의 경우 녹는점이 28 o C에서 시작하는 옥타데칸에서 알칸의 응집 상태는 견고합니다. 고체 탄화수소에는 파라핀이 포함되며 고급 액체 탄화수소에는 파라핀 오일이 포함됩니다. 소수성 특성으로 인해 알칸 분자는 물과 혼합되지 않고 물에 젖지 않으며 물에 용해되지 않습니다. 그러나 비극성 특성에 대한 친화력으로 자체 및 유사한 비극성, 중극성 및 저극성 유기 용매에 쉽게 용해됩니다. 널리 사용되는 두 가지 알코올 용매(메탄올 및 에탄올)에서 알칸의 용해도는 상대적으로 양호합니다. 메탄올에서 알칸은 지정된 농도까지만 잘 용해됩니다. 그 농도를 초과하면 상이 분리됩니다. 에탄올에서 저급 알칸은 매우 쉽게 용해되는 반면 고급 알칸은 용해되기가 약간 더 어렵습니다. 고급 탄화수소는 가연성 물질입니다. 기체 탄화수소와 액체 탄화수소 쌍은 공기와 혼합될 때 폭발 가능성이 있는 혼합물을 형성합니다. 알칸의 반응성은 잠재적으로 반응할 수 있는 작용기가 없기 때문에 상대적으로 낮습니다. 탄소 원자(CC) 사이의 결합뿐만 아니라 탄소와 산소 원자(CH) 사이의 결합은 분해에 매우 강합니다. 이러한 결합의 에너지는 각각 88kcal/mol 및 104kcal/mol입니다. 특정 조건에서만 갑자기 반응할 수 있습니다.
알칸의 반응
- 완전 연소 – 이산화탄소 배출
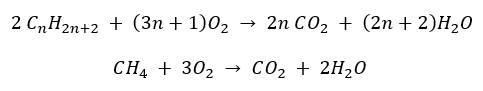
- 반연소 – 제한된 산소와 일산화탄소 배출
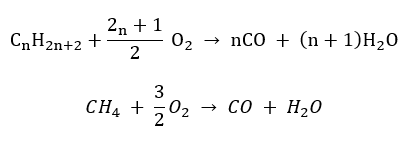
- 불완전 연소 – 매우 제한된 양의 산소로 카본 블랙이 형성됩니다.
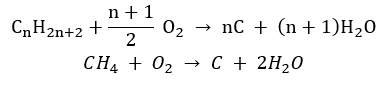
- 치환 반응(빛의 참여로 메탄과 염소의 반응으로 예시되는 라디칼 할로겐화)
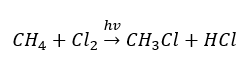
- 열분해는 매우 높은 온도에서 알칸이 더 작은 분자로 분해되는 것입니다. 공정에 따라 균열, 수소화 분해 또는 이성질화가 발생할 수 있습니다.
- 질산(V) 산을 사용한 니트로화 및 제품 혼합물 형성: 다양한 위치에 –NO 2 치환기가 있는 이성질체.
- 메르솔이 중간 생성물이고 메르솔란이 최종 생성물인 2단계 술폰화.