알켄은 불포화 탄화수소로, 알칸처럼 상동 계열을 형성합니다. 그러나 알칸과 달리 알켄은 탄소 원자 사이에 하나의 다중 결합(이중 결합)을 가지고 있습니다. 나머지는 단일 결합이지만 분자 내에 다중 결합이 하나만 있어도 탄화수소는 불포화 화합물이 됩니다.

알켄의 구조
포화 탄화수소에서 원자 사이의 CC 결합은 이들 각각이 sp 3 혼성화를 갖도록 합니다. C=C 결합을 갖는 알켄에서는 sp 2 혼성화가 발생합니다. 이 속성은 이중 결합을 가진 화합물의 구조가 삼각 형태가 되도록 합니다. 그것의 3 시그마 결합은 같은 평면에 있고 정삼각형의 모서리를 향하고 있으며 그 중심은 탄소 원자입니다. 대조적으로, 파이 결합은 혼성 오비탈과 이웃 원자의 유사한 대칭의 오비탈로 형성된 삼각형에 수직인 방향으로 비혼성 p 오비탈이 중첩되어 발생합니다. 그룹의 가장 간단한 구성과 알켄 동족 계열의 첫 번째 화합물은 에텐입니다. 첫 번째 알칸 화합물인 메탄은 다중 결합을 형성할 수 없습니다.
알켄 구조의 예
그룹의 가장 단순한 화합물인 에텐을 선택하고 그 구조를 조사해 봅시다. 우리는 에텐 분자의 탄소 원자가 sp 2 혼성화를 가지고 있어서 분자가 편평하다는 것을 알고 있습니다. 이 레이아웃에서 결합 사이의 각도는 120 ° 입니다. 구조 CH에 존재하는 탄소 원자와 수소 원자 사이의 4개의 결합은 정면으로 겹치는 시그마 δ SP-s 결합입니다. 탄소 원자 사이에 형성된 동핵 결합도 있습니다. 하나는 CC δ sp-sp 이고 다른 하나는 비 하이브리드 p 오비탈로 구성된 CC π pp 입니다. 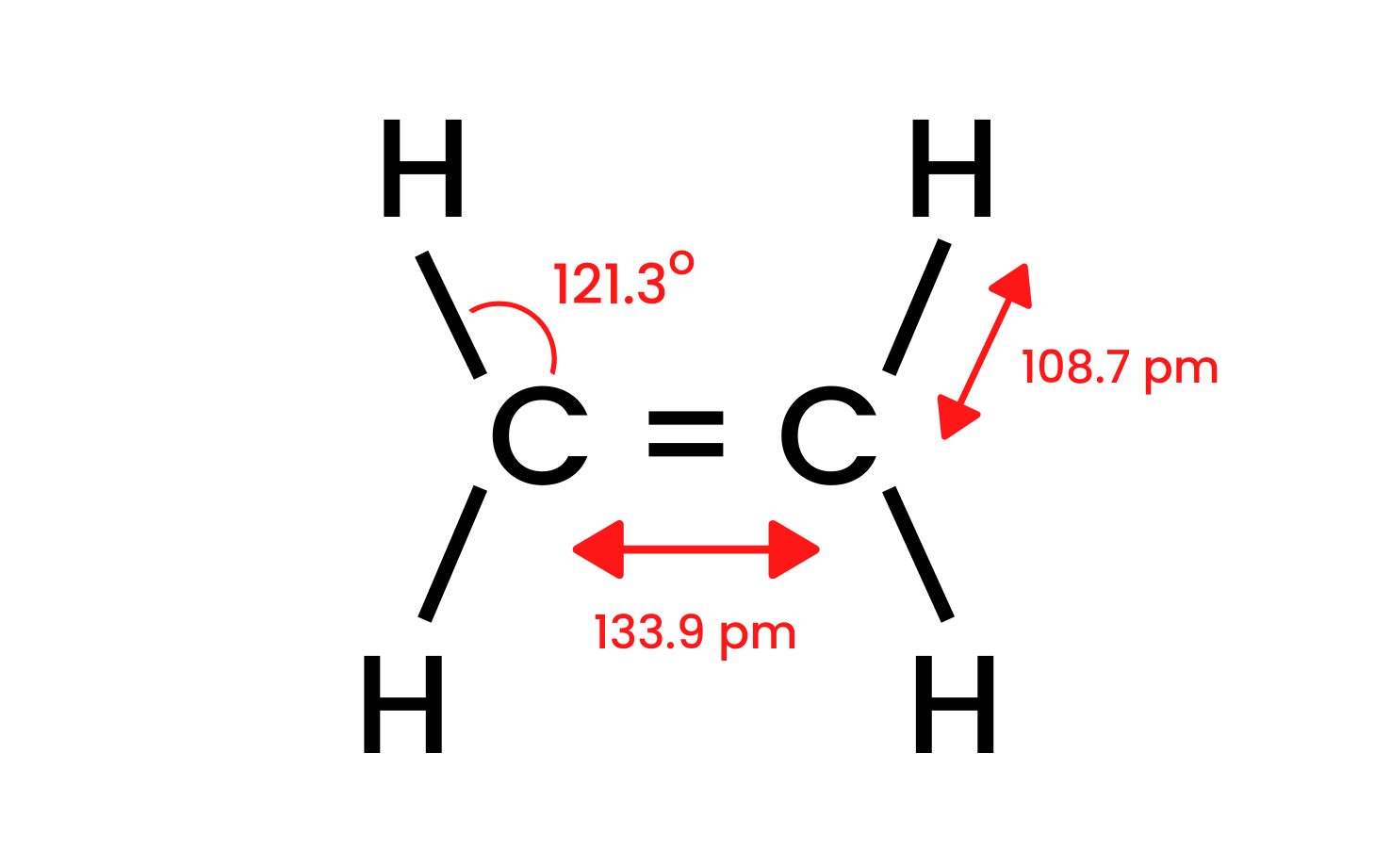 의 구조
의 구조
알켄 상동 시리즈
상동 계열은 매우 유사한 화학 구조와 특성을 갖는 화합물 그룹입니다. 이러한 물질은 일반적인 분자식으로도 쓸 수 있습니다. 알켄의 일반식은 C n H 2n 으로 쓸 수 있습니다. 구조적으로 다음과 같습니다.
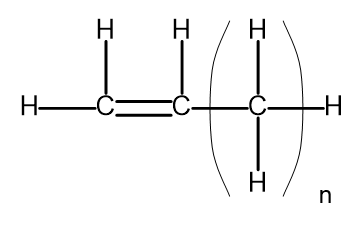
그림 2. 알켄의 일반 구조식
| 사슬의 탄소 원자 수 | 알칸 공식 | 알칸 이름 | 알켄 공식 | 알켄 이름 |
| 2 | C2H6 _ | 에탄 | C2H4 _ | 에텐 |
| 삼 | C3H8 _ | 프로판 | C3H6 _ | 프로펜 |
| 4 | 씨 4 시 10분 | 부탄 | C4H8 _ | 부텐 |
| 5 | C5H12 _ | 펜탄 | 씨 5 시 10분 | 펜텐 |
| 6 | 6 시간 14분 | 헥산 | 6 시간 12분 | 헥센 |
| 7 | C7H16 _ | 헵탄 | C7H14 _ | 헵텐 |
| 8 | 시 8 시 18분 | 옥탄 | 씨 8 시 16분 | 옥텐 |
| 9 | 9 시간 20분 | 노난 | C9H18 _ | 노네네 |
| 10 | 씨 10 시 22분 | 데칸 | 씨 10 시 20분 | 데센 |
부텐에서 데센으로의 화합물은 탄소 원자의 동일한 위치에 가지를 가질 수 있으므로 부트-1-엔, 헵트-1-엔 또는 데크-1-엔이라고도 합니다. 이것은 사슬을 시작하는 탄소 원자 사이에 불포화 결합이 존재한다는 것을 의미합니다. 불포화 다중 결합의 배치 가능성이 다양한 현상을 위치 이성질체 현상이라고 합니다. 예를 들어, 분자식이 C 7 H 14 인 화합물은 몇 가지 가능한 위치 이성질체를 가지고 있습니다. 그 구조의 이중 결합은 예를 들어 그림 3과 같이 탄소 원자 1번과 3번에 위치할 수 있습니다.
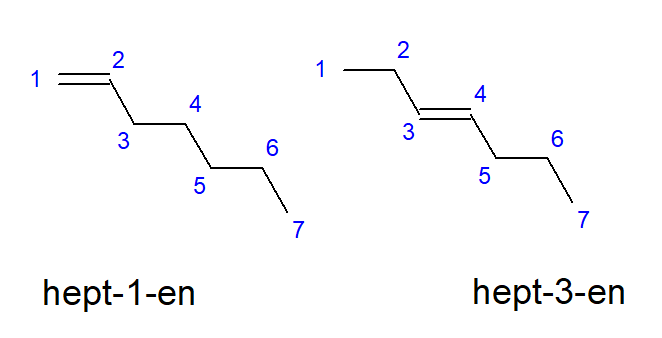
그림 3. hept-1-ene(1-heptene) 및 hept-3-ene(3-heptene)
알켄의 구조 – 요약
각 알켄에는 편평한 구조가 생성되는 이중 파이 결합(π)이 있습니다. 탄소 원자는 삼각 형태를 특징으로 하는 sp 2 혼성화를 갖는다. 포화된 위치에서 -CH 2 – 메틸렌 그룹은 공간적으로 확장된 직쇄 및 분지쇄를 생성할 수 있습니다. 회전은 단일 결합 주위에서만 발생하며 C=C 결합의 경우에는 발생하지 않습니다. 알켄 그룹의 기본 물리적 및 화학적 특성 알켄은 소수성 특성을 가지므로 비극성 특성을 갖습니다. 그들은 물과 반응을 시작합니다. 친화성 때문에 알칸과 같은 비극성 용매에 잘 용해됩니다. 녹는점, 끓는점 및 알켄의 밀도는 분자의 탄소 원자 수가 증가함에 따라 증가합니다. 그들의 활동은 단쇄 알켄에서 가장 큽니다.
알켄 얻기
알켄을 얻는 방법에는 여러 가지가 있습니다. 이러한 각 방법은 다이어그램
그림 4. 알켄
에텐 얻기
1. 알칸의 탈수소화 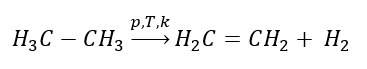 2. 알코올 탈수
2. 알코올 탈수 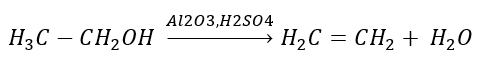 3. 할로겐-알칸과 강염기의 반응
3. 할로겐-알칸과 강염기의 반응 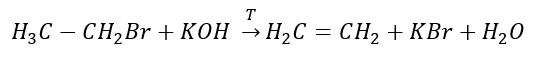 4. 디할로겐-알칸과 아연 분진의 반응
4. 디할로겐-알칸과 아연 분진의 반응 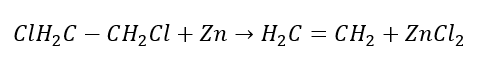 5. 알킨의 수소화
5. 알킨의 수소화 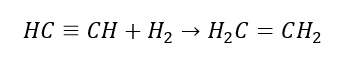
알켄의 화학 반응
동시에 특성과 소속을 정의하는 입자 특정 조각을 작용기라고 합니다. 알켄의 경우 이 그룹은 이중 결합(C=C)입니다. 포함된 파이 결합(π)은 깨지기 매우 쉽습니다. 시그마 결합의 전자와 비교할 때 파이 오비탈을 차지하는 전자는 탄소 원자에서 더 멀리 떨어져 있으므로 관련성이 적습니다. 그 결과 접근하는 시약에 대한 이동성과 가용성이 높아져 결합의 화학적 반응성이 높아집니다. 알켄이 변형되는 반응에는 몇 가지 유형이 있습니다. 이들은 친전자성 첨가, 자유 라디칼 첨가, 산화 및 환원, 중합 및 알릴 치환입니다.
친전자성 첨가
파이 결합의 전자 특성 때문에 전자를 공격하는 작용제는 전기 양성 특성을 가집니다. 이러한 분자는 전자에 대해 높은 친화력을 갖는 친전자성 시약입니다. 대부분의 경우 이 인자는 산 기원의 양성자, 전자 갭 또는 파이 전자에 가까워 쉽게 분극화되는 분자입니다. 추가, 즉 연결 반응은 이온 메커니즘을 따릅니다. 이것은 초기에 접근하는 친전자성 시약이 단일 결합의 생성과 일시적 탄소양이온의 형성으로 파이 결합의 전자를 포획하는 2단계 메커니즘입니다. 반응성이 높은 이 분자는 전자를 상호화할 수 있는 능력이 있는 다른 시약을 빠르게 공격합니다. 이러한 반응의 예는 알켄에 염소 또는 브롬을 첨가하는 것입니다. 첨가 방식으로 수소를 첨가할 수도 있지만(수소화) 친전자성이 아닙니다.
자유 라디칼 추가 반응
알켄의 많은 반응은 Markovnikov의 규칙을 따르지 않음을 보여줍니다. 그들의 메커니즘은 탄소 공격 입자 결합이 생성되는 동안 파이 결합의 전자와 자유 라디칼의 반응에 중점을 둡니다. 이러한 변화의 결과로 이웃한 탄소 원자에 짝을 이루지 않은 전자를 갖는 새로운 자유 라디칼이 생성됩니다.
알릴 대체
이중 결합과 관련된 반응 외에도 알켄은 이웃한 알킬 그룹의 알칸과 유사한 방식으로 반응할 수 있습니다. 이러한 반응의 예는 이중 결합을 형성하는 탄소 원자 옆의 원자에서 수소 원자를 할로겐으로 치환하는 것입니다. 이 반응은 구조의 불포화 부분에 영향을 미치지 않습니다.
