화학 분석에 사용되는 가장 오래된 기기 방법 중 하나입니다. 그 기초는 18 세기 에서 19 세기 사이에 L. Galvani, CA Volta, JW Gibbs 및 W. Nernst에 의해 마련되었습니다. 전위차법으로 수행되는 측정은 테스트 용액에 담긴 두 개의 전극으로 구성된 셀의 기전력(EMF)을 사용합니다. 그 힘의 값은 사용된 전극의 전위에 직접적으로 의존합니다. 이는 차례로 전해질 용액에 포함된 이온의 활동과 전극 프로세스의 특성에 따라 달라집니다.
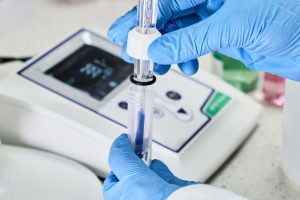
Daniell 전지로 예시되는 전극 프로세스 다이어그램
Daniell 셀은 두 개의 반쪽 셀로 구성되며 각각 자체 염 용액에 담근 금속으로 구성됩니다. 구성 요소 반쪽 전지는 Cu (s) /Cu 2+ (aq) 및 Zn (s) /Zn 2+ (aq) 시스템입니다. 그들 각각은 다음 산화 환원 반응 중 하나를 겪습니다.
- 절감
Cu 2+ (aq) + 2e – → Cu (s)
- 산화
Zn (s) → Zn 2+ (aq) + 2e – 두 반응을 결합하면 셀에서 발생하는 반응에 대한 전체 방정식을 얻습니다. Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) 전지의 특정 기전력을 측정하기 위해서는 염다리를 이용하여 반쪽 전지를 연결하고 전극을 전압계에 연결해야 합니다. 따라서 셀의 EMF 값을 나타내는 개별 전극 사이의 전위차를 측정 할 수 있습니다. IUPAC 규약에 따르면 Daniell 셀의 다이어그램은 다음과 같습니다. ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ 단일 선은 인터페이스를 나타내고 이중 선은 염다리를 나타냅니다. 계면의 전위는 산화 및 환원 반응의 결과입니다. 전지의 경우 산화가 일어나는 전극은 ϴ 기호가 있는 양극이고 다른 전극은 환원이 일어나는 양극이라고 가정합니다. 표기는 양극에서 시작하고 음극은 오른쪽에 표시됩니다 . 이러한 셀의 기전력은 다음 공식에 따라 계산할 수 있습니다. EMF = 음극 전위 – 양극 전위
표준 전극 전위
이 용어는 체계화를 위해 도입되었으며 전극의 결정된 전위는 몇 가지 조건을 만족하면 "표준"으로 간주됩니다. 측정은 298K에서 수행되어야 하고, 활성 이온의 활동도는 1mol/ dm3 와 같아야 하며, 기준 전극은 해당 전극의 전위가 0.0000V라고 가정하므로 표준 수소 전극이어야 합니다.
전지의 기전력
EMF 값은 세포에 존재하는 이온의 활동 변화에 따라 변합니다. 이 관계를 반영하는 방정식을 Nernst 방정식 이라고 합니다. 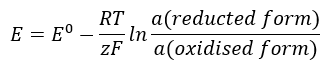 다음 기호를 사용합니다: 전극 전위(E), 표준 전극 전위(E 0 ), 8.312 J/K·mol과 같은 기체 상수(R), 온도(T), 전자의 전기화학 반응에 관여하는 전자의 수 (z), 패러데이 상수(F)는 9.64853·10 4 C/mol, 환원 및 산화 형태의 이온 활성. 고체의 경우 활동도(a)는 1로 가정합니다.
다음 기호를 사용합니다: 전극 전위(E), 표준 전극 전위(E 0 ), 8.312 J/K·mol과 같은 기체 상수(R), 온도(T), 전자의 전기화학 반응에 관여하는 전자의 수 (z), 패러데이 상수(F)는 9.64853·10 4 C/mol, 환원 및 산화 형태의 이온 활성. 고체의 경우 활동도(a)는 1로 가정합니다. 
전위차 계측
전위차 측정을 위한 기본 세트는 테스트 용액에 담긴 한 쌍의 전극과 측정 장치의 두 가지 구성 요소로 구성됩니다. 첫 번째 구성 요소는 측정 셀 이고 두 번째 구성 요소는 기전력의 실제 측정을 가능하게 합니다. 세포에서 가장 중요한 부분은 전극입니다. 작용 메커니즘에 따라 네 가지 그룹으로 분류할 수 있습니다.
소금다리
모든 셀의 중요한 요소 는 기준 전극이 테스트된 용액과 접촉할 수 있게 해주는 염다리 입니다. 전이가 있는 전지의 기본 특성은 농도와 조성이 다른 전해질 간의 접촉입니다. 브리지의 전해질과 테스트 용액의 혼합을 방지하기 위해 작은 접촉 표면이 사용됩니다.
제1종 전극
이 전극은 자체 이온을 포함하는 용액에 담긴 금속 또는 가스로 만들어집니다 . 표면에서 다음과 같은 가역 반응이 발생하므로 양이온에 대해 가역적인 전극 이라고도 합니다. M 0 ↔ M n+ + ne 첫 번째 종류의 전극의 예는 수소 전극입니다.
두 번째 종류의 전극
이러한 전극은 난용성 염으로 덮힌 금속으로 만들어집니다 . 시스템은 난용성 염과 동일한 음이온을 포함하는 자유롭게 용해되는 염에 잠겨 있습니다. 이러한 전극은 표면에서 다음 과 같은 반응이 일어나기 때문에 일반 음이온에 대해 가역적인 전극 이라고 합니다 .
제3종 전극
이것들은 두 개의 층으로 둘러싸인 금속으로 구성되어 있습니다. 첫 번째는 그 금속의 난용성 염으로 만들어진 얇은 층이고, 두 번째 층은 동일한 음이온을 포함하는 약간 더 잘 녹는 염으로 구성됩니다. 그것들은 표면에서 다음과 같은 반응이 발생하기 때문에 일반적인 양이온으로 가역적인 전극 입니다. M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
레독스 전극
이러한 전극의 구조 는 화학적으로 불활성인 금속(예: 백금 또는 금)을 사용하는 것이 특징이며, 이는 환원 및 산화 형태의 물질을 포함하는 용액에 담겨 있습니다. 그러한 전극의 예는 퀸하이드론 전극이다.
시스템에서 전극의 기능
분석 시스템의 적용 측면에서 우리는 다음을 구분합니다.
- 측정 조건이나 테스트 용액의 농도에 관계없이 일정한 전위를 유지하는 기준 전극 .
- 테스트 용액에 민감한 이온이 포함되어 있으면 전위가 변경되는 지시 전극 .
기준 전극
전위차 측정은 기준 전극과 표시 전극의 전위 비교를 기반으로 합니다. 이러한 이유로 이러한 전극은 다음과 같은 특징이 있어야 합니다.
- 안정적인 잠재력,
- 재현 가능성 및 온도 독립성,
- 다용도성과 사용 편의성,
- 낮은 전기 저항,
- 재현 가능하고 낮은 확산 가능성,
- 테스트 용액으로 전극의 전해질이 거의 흐르지 않습니다.
일반적으로 사용되는 기준 전극은 염화은 이온의 존재에 반응하는 은-염화은 전극(Ag/AgCl/KCl)입니다. 그것은 염화은 층으로 코팅된 은선으로 만들어졌습니다. 또 다른 예는 calomel 전극(Pt/Hg/Hg 2 Cl 2 /KCl)이며, 전위는 염화물 이온 용액의 활동도에 따라 달라집니다.
지시 전극
이 범주의 전극의 경우 용액에 테스트된 이온이 있으면 전위가 변경됩니다 . 이것은 그들의 잠재력이 활동에 직접적으로 의존한다는 것을 의미하며, 또한 그들이 놓인 용액의 농도도 마찬가지입니다 . 가장 일반적으로 사용되는 것은은, 수은 또는 수소 전극과 같은 자체 이온 용액에 담긴 전극입니다. 그러나 현대 전위차법에서는 이온 선택성 막 전극이 사용됩니다. 예를 들어 활성 부분이 막이고 용액의 이온과 막 사이의 이온 반응이 계면에서의 전위차를 결정하는 것과 같은 몇 가지 공통적인 특성을 가지고 있습니다. 이러한 전극은 그 구조에 따라 유리전극, 고체막, 액체막, 이중막 전극으로 나눌 수 있다. 가장 자주 사용되는 것은 유리 전극으로, 전극 유리로 만든 벽이 얇은 전구로 끝나는 유리관으로 구성됩니다. 그것은 이온의 일정한 활동으로 내부 용액에 담긴 내부의 은-염화은 전극을 수용합니다.
