카르복실산은 구조를 보면 중요한 유기화합물이며 아실 유도체이다. 그들은 에스테르 및 아미드를 포함한 많은 유도체를 위한 건축 자재의 일종입니다. 자연에서는 식탁용 식초의 기본 화합물인 아세트산 CH 3 COOH, 산패한 버터 냄새의 원인이 되는 부티르산 CH 3 CH 2 CH 2 COOH 등과 같은 다양한 카르복시산을 찾을 수 있습니다. 인간 담즙액의 기본 성분인 복합 콜산.

카르복실산의 일반 공식은
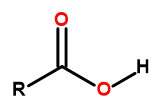
그림 1 카르복실산의 일반식은 다음과 같습니다.
카르복실산의 명명법
IUPAC 명명법에 따르면 카르복실산은 분자의 크기와 복잡성에 따라 두 가지 방식으로 명명할 수 있습니다. 지방족 유도체인 산은 -ane에서 -oic으로 끝나는 알칸을 변경하고 예를 들어 프로판산, 부탄산, 3-에틸-6-메틸옥탄디오익산과 같이 첫 단어 "산"을 추가하여 체계적으로 명명됩니다. 이러한 화합물의 탄소 원자 번호는 항상 -COOH 작용기의 원자부터 시작합니다. 카르복실 그룹이 고리에 부착된 산에 특히 유용한 두 번째 명명 체계는 화합물의 체계적 이름 앞에 "산"이라는 단어를 추가하고 그 뒤에 "카르복실"이라는 단어를 추가할 수 있습니다. 이러한 경우 탄소 원자의 번호 매기기는 카르복실기가 부착된 원자로 시작하며 카르복실기 자체는 치환기로 취급됩니다. 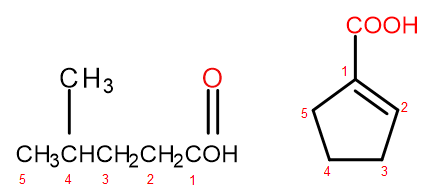 카르복실산이 최초로 분리, 정제 및 특성화되었다는 역사적 개요로 인해 유기 화합물의 경우, IUPAC 시스템은 또한 유기 화합물과 그 아실 그룹 모두에 대해 많은 공통 이름을 허용합니다. 표 1 카르복실산 및 그 아실 그룹의 일반적인 이름의 선택된 예.
카르복실산이 최초로 분리, 정제 및 특성화되었다는 역사적 개요로 인해 유기 화합물의 경우, IUPAC 시스템은 또한 유기 화합물과 그 아실 그룹 모두에 대해 많은 공통 이름을 허용합니다. 표 1 카르복실산 및 그 아실 그룹의 일반적인 이름의 선택된 예.
| 카르 복실 산 | 아실기 | ||
| 구조 | 이름 | 구조 | 이름 |
| HCOOH | 개미 | HCO- | 포르밀- |
| CH3COOH | 초의 | CH3CO- | 아세틸- |
| CH3CH2CH2COOH _ _ | 부티르산 | CH3CH2CH2CO- _ _ | 부티릴- |
| 후쿠 | 옥살산 | -OCCO- | 옥살릴- |
| HOOC( CH2 ) 2COOH | 숙신산 | -OC( CH2 ) 2CO- | 석시닐- |
카르복실산의 구조와 물성
케톤과 알코올 모두에 대한 카르복실기의 유사성은 유사한 물리적 특성을 암시할 수 있습니다. 케톤에서와 같이 작용기의 탄소 원자는 sp 2 혼성화를 가집니다. 이것은 평평한 구조와 CCO와 OCO 결합 사이의 각도가 약 120 ° 인 것과 직접적인 관련이 있습니다. 예를 들어, 아세트산 CH 3 COOH 의 결합각은 다음과 같습니다.
- CC= O 에 대해 119o,
- CC-OH의 경우 119o ,
- O =C-OH인 경우 122o.
본드 길이는 다음과 같습니다.
- CC의 경우 52Å,
- C=O의 경우 25Å,
- C-OH의 경우 31Å.
카르복실산은 수소 결합을 형성할 가능성으로 인한 강한 결합성으로 인해 알코올 과 유사성을 보입니다. 실제로, 이러한 화합물의 대부분은 수소 결합의 형성에 의해 구조가 유지되는 고리형 이합체로 존재합니다. 이러한 특정 수소 결합 시스템은 카르복실산의 끓는점에도 영향을 미칩니다. 해당 알코올에 비해 크게 증가합니다. 예를 들어, 물리적 상수 – 섭씨 온도의 녹는점과 끓는점은 각각 다음과 같습니다.
- 포름산 : 8.4; 100.7,
- 아세트산: 16.6; 117.9,
- 프로판산: -20.8; 141,
- 벤조산: 122.1; 249.
카르복실산의 해리
이 화합물 그룹의 산성 특성으로 인해 수산화나트륨 및 중탄산칼륨을 비롯한 염기와 반응할 수 있습니다. 이러한 반응의 생성물은 카르복실산의 염이다. 카복실산의 물에 대한 용해도는 무시할 만하지만 이온 구조로 인해 알칼리 금속과의 염은 물에 잘 용해됩니다. Bronsted-Lowry 이론에서 산인 이 화합물은 묽은 수용액에서 해리됩니다. 변환 결과, 카르복실레이트 음이온 RCOO – 및 하이드로늄 양이온 H 3 O + 가 형성된다. 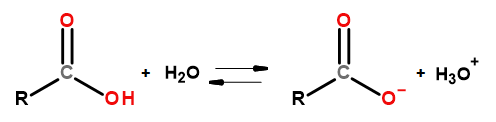 다른 산과 마찬가지로 산 상수(K a )와 로그를 작성할 수 있습니다.
다른 산과 마찬가지로 산 상수(K a )와 로그를 작성할 수 있습니다. 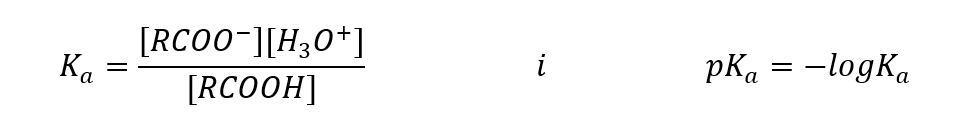 카르복실산에 대해 경험적으로 결정된 값은 카르복실산이 약하게 해리된 화합물임을 나타내므로 실제로는 카르복실산도 약산입니다. 대부분의 경우 K a 상수는 약 10 -5 의 값을 갖습니다. 아세트산 K a = 1.76·10 -5 의 경우 변환 후 pK 값이 4.75가 됩니다. 이것은 분자의 약 0.1%만 해리되는 것과 같으며, 이는 해리도가 100%인 강한 무기산과 비교하여 이들이 저강도 산임을 확인시켜줍니다. 평형 상수가 10 -16 크기로 진동하는 알코올에 비해 카르복실산은 훨씬 더 강합니다. 구조적 유사성에도 불구하고 이러한 사실은 알콕사이드 음이온에 비해 카르복실레이트 음이온의 안정성 때문입니다. 알콕사이드의 음전하는 전기음성도가 높은 단일 산소 원자에 있음에 유의하십시오. 대조적으로, 카르복실레이트 음이온에서 전하는 관능기의 두 산소 사이에서 비편재화됩니다. 이것은 알코올에 의해 생성되는 음이온에 비해 더 안정적입니다.
카르복실산에 대해 경험적으로 결정된 값은 카르복실산이 약하게 해리된 화합물임을 나타내므로 실제로는 카르복실산도 약산입니다. 대부분의 경우 K a 상수는 약 10 -5 의 값을 갖습니다. 아세트산 K a = 1.76·10 -5 의 경우 변환 후 pK 값이 4.75가 됩니다. 이것은 분자의 약 0.1%만 해리되는 것과 같으며, 이는 해리도가 100%인 강한 무기산과 비교하여 이들이 저강도 산임을 확인시켜줍니다. 평형 상수가 10 -16 크기로 진동하는 알코올에 비해 카르복실산은 훨씬 더 강합니다. 구조적 유사성에도 불구하고 이러한 사실은 알콕사이드 음이온에 비해 카르복실레이트 음이온의 안정성 때문입니다. 알콕사이드의 음전하는 전기음성도가 높은 단일 산소 원자에 있음에 유의하십시오. 대조적으로, 카르복실레이트 음이온에서 전하는 관능기의 두 산소 사이에서 비편재화됩니다. 이것은 알코올에 의해 생성되는 음이온에 비해 더 안정적입니다.
카르복실산 얻기
- KMnO 4 또는 Na 2 Cr 2 O 7 로 치환된 알킬벤젠을 치환된 벤조산 형태의 생성물로 산화. 1차 및 2차 알킬기를 산화시킬 수 있으며,
- KMnO 4 를 사용하여 하나 이상의 비닐 수소 원자를 갖는 알켄의 C=C 결합의 산화,
- 1차 알코올 및 알데히드의 산화. Jones 시약을 사용하는 알코올, 동일한 시약과 염기성 산화은을 사용하는 알데히드,
- 강하고 뜨거운 산 또는 염기 용액의 영향으로 니트릴의 가수분해,
- Grignard 화합물과 이산화탄소의 반응, 카르복실산 마그네슘 형태의 중간 생성물. 그런 다음 전이 화합물은 산과 반응합니다.
카르복실산의 반응
카르복실산은 그 구조로 인해 특징적인 반응 외에도 알코올 및 케톤과 유사한 변형을 겪습니다. 알코올과 마찬가지로 양성자를 해리하여 친핵성 시약을 형성할 수 있습니다. 케톤과 마찬가지로 카르보닐 그룹의 탄소 원자에 대한 다른 친핵체의 공격을 받기 쉽습니다. 또한 환원, 알파 위치의 치환, 아실 그룹의 친 핵성 치환 및 탈 양성자 화 (해리)가 가능합니다. 카복실산의 환원은 LiAlH 4 로 발생하여 생성물을 1차 알코올로 제공합니다. 때로는 효율성을 높이기 위해 테트라히드로푸란 용액에서 가열을 적용해야 합니다. 또 다른 방법은 테트라히드로푸란 용액에서 보란을 사용하여 환원하는 것으로 역시 1o 알코올을 얻습니다.
