화학량론은 화학 반응의 정량적 과정에 관한 계산을 다루는 일반 화학의 한 분야입니다. 실험실에서 작업할 때 수행 중인 화학 반응이 완전히 일어나거나 제품의 양을 얻기 위해 사용해야 하는 기질의 양(질량, 부피, 분자)을 알아야 하는 경우가 많습니다. 우리는 원한다. 때로는 실험이 예상과 다르게 진행되도록 하는 기질의 과잉 또는 부족을 계산해야 하는 경우도 있습니다. 이러한 각 계산은 화학 반응 방정식의 정량적 해석에서 직접 따르며 질량 보존 법칙을 사용합니다. 이러한 유형의 방정식을 화학양론적 계산이라고 합니다.

우리는 무엇을 알아야 합니까?
화학양론을 사용하려면 화학 반응 방정식, 화학양론 계수, 기체의 몰 및 몰 질량, 몰 부피, 아보가드로의 법칙을 포함한 여러 분야에 대한 지식이 필요합니다. 화학 반응의 화학양론에 대한 지식을 사용하면 다음과 같은 많은 계산 문제를 해결할 수 있습니다.
- 원소 분석,
- 몰 계산,
- 질량 계산,
- 반응에서 제한 물질을 결정할 수 있는 비화학양론적 혼합물의 계산,
- 반응 수율.
몰 질량
개별 원자와 분자의 질량은 상상할 수 없을 정도로 작기 때문에 원자 질량을 나타내는 단위(u) 가 만들어졌습니다. 실제로 이는 탄소 동위원소 12C 질량의 1/12에 해당하는 값입니다. 물질의 이 부분은 아보가드로 상수 와 밀접하게 관련되어 있으며 6.022·10을 포함하는 물질의 그램 수로 결정됩니다. 23 개의 원자, 분자 또는 이온. 몰 질량 [M]은 원자 또는 분자 질량 과 수치적으로 동일하며 단위는 g/mol입니다.
물질의 몰 부피 [Vm]
이는 온도 및 압력 조건에 따라 크게 달라지는 물질별 값입니다. 이것은 1몰이 차지하는 물질의 부피입니다. 정상적인 조건에서는 22.4dm 3 의 상수 값이 채택됩니다.
일정 구성의 법칙과 질량 보존의 법칙
모든 화합물은 그 기원과 획득 방법에 관계없이 잘 정의되고 일정한 질적, 양적 구성을 가지고 있습니다. 예를 들어, 황산(IV) 산화물은 항상 이 원소의 50wt%황과 황(VI) 산화물을 40wt%함유합니다. 닫힌 시스템에서 생성된 생성물의 질량은 반응 중에 소비된 기질 의 질량과 같습니다. 질량 보존의 법칙은 존재하는 원자 수 측면에서 방정식의 양측이 동일하도록 각 화학 반응 방정식과 적절한 화학 계수의 균형을 맞춰야 한다는 필요성에 반영됩니다. 화학량론적 비율은 화학 반응에 존재하는 반응물의 몰 비율을 반영합니다.
화학 반응식
화학 물질 간의 상대적 관계에 필요한 모든 정보는 화학 반응식에서 파생됩니다. 이는 몇 가지 중요한 상대적 정보와 정량적 정보를 제공합니다.
예시 1.
암모니아 합성 방정식에서 다음과 같은 반응이 나타납니다. ![]() 분자, 몰, 몰 질량, 몰 부피, 분자 수 등 다양한 해석을 수행할 수 있습니다. a) 분자적으로, 우리는 세 개의 수소 분자가 한 분자의 질소와 반응하여 두 개의 암모니아 분자를 형성한다는 것을 읽을 수 있습니다. b) 이는 또한 3몰의 수소가 1몰의 질소와 반응하여 2몰의 암모니아 생성물을 형성한다는 것을 의미합니다. c) 개별 원자의 몰 질량을 포함하는 화학 원소 주기율표를 사용하여 방정식에서 6g의 수소가 28g의 질소와 완전히 반응하여 34g의 암모니아를 형성한다는 결론을 내릴 수도 있습니다. d) 그러면 정상적인 조건을 가정하면 기체 1몰이 22.4dm 3 을 차지한다는 것을 알 수 있습니다. 이를 통해 우리는 67.2dm3 의 수소가 22.4dm3 의 질소와 반응하여 44.8dm3 의 암모니아를 형성한다는 결론을 내릴 수 있습니다. e) 또 다른 유용한 관계식은 아보가드로(Avogadro)의 법칙입니다. 이는 동일한 부피의 서로 다른 가스에는 동일한 압력 및 온도 조건에서 동일한 수의 입자가 포함되어 있음을 나타냅니다. 아보가드로 상수 6.022·10 23 을 알면 암모니아 합성을 위한 완전한 화학 반응을 수행하려면 3·6.022·10 23 수소 분자와 6.022·10 23 질소 분자가 필요하다는 것을 알 수 있습니다 . 반응으로 2·6.022·10 23 암모니아 분자가 생성됩니다.
분자, 몰, 몰 질량, 몰 부피, 분자 수 등 다양한 해석을 수행할 수 있습니다. a) 분자적으로, 우리는 세 개의 수소 분자가 한 분자의 질소와 반응하여 두 개의 암모니아 분자를 형성한다는 것을 읽을 수 있습니다. b) 이는 또한 3몰의 수소가 1몰의 질소와 반응하여 2몰의 암모니아 생성물을 형성한다는 것을 의미합니다. c) 개별 원자의 몰 질량을 포함하는 화학 원소 주기율표를 사용하여 방정식에서 6g의 수소가 28g의 질소와 완전히 반응하여 34g의 암모니아를 형성한다는 결론을 내릴 수도 있습니다. d) 그러면 정상적인 조건을 가정하면 기체 1몰이 22.4dm 3 을 차지한다는 것을 알 수 있습니다. 이를 통해 우리는 67.2dm3 의 수소가 22.4dm3 의 질소와 반응하여 44.8dm3 의 암모니아를 형성한다는 결론을 내릴 수 있습니다. e) 또 다른 유용한 관계식은 아보가드로(Avogadro)의 법칙입니다. 이는 동일한 부피의 서로 다른 가스에는 동일한 압력 및 온도 조건에서 동일한 수의 입자가 포함되어 있음을 나타냅니다. 아보가드로 상수 6.022·10 23 을 알면 암모니아 합성을 위한 완전한 화학 반응을 수행하려면 3·6.022·10 23 수소 분자와 6.022·10 23 질소 분자가 필요하다는 것을 알 수 있습니다 . 반응으로 2·6.022·10 23 암모니아 분자가 생성됩니다.
예시 2.
다음 방정식에 따라 발생하는 염소 내 마그네슘의 연소 반응: ![]() 이전 예와 유사한 해석을 생각해 낼 수 있습니다. a) 제시된 방정식을 통해 언뜻 보기에도 염화마그네슘 1분자를 얻기 위해서는 기질로 마그네슘 1분자와 염소 1분자를 공급해야 한다는 결론을 내릴 수 있습니다. b) 이는 물론 시스템에 존재하는 몰수, 즉 마그네슘 1몰, 염소 1몰, 염화마그네슘 1몰과 동일합니다. c) 질량 계산을 위해 24g의 마그네슘이 71g의 염소와 반응하여 95g의 염화마그네슘을 생성한다는 것을 알고 있습니다. d) 고려 중인 화학 반응에는 오직 하나의 기체인 염소 만 관여하므로, 이 기체가 22.4 dm 3 의 부피를 차지한다고 쓸 수도 있습니다. e) 입자 수에서 각 성분은 다른 성분과 동일하며 값은 6.022·10 23 입니다.
이전 예와 유사한 해석을 생각해 낼 수 있습니다. a) 제시된 방정식을 통해 언뜻 보기에도 염화마그네슘 1분자를 얻기 위해서는 기질로 마그네슘 1분자와 염소 1분자를 공급해야 한다는 결론을 내릴 수 있습니다. b) 이는 물론 시스템에 존재하는 몰수, 즉 마그네슘 1몰, 염소 1몰, 염화마그네슘 1몰과 동일합니다. c) 질량 계산을 위해 24g의 마그네슘이 71g의 염소와 반응하여 95g의 염화마그네슘을 생성한다는 것을 알고 있습니다. d) 고려 중인 화학 반응에는 오직 하나의 기체인 염소 만 관여하므로, 이 기체가 22.4 dm 3 의 부피를 차지한다고 쓸 수도 있습니다. e) 입자 수에서 각 성분은 다른 성분과 동일하며 값은 6.022·10 23 입니다. 
화학 반응의 백분율 수율 [ %W]
화학량론적 계산은 반응 수율, 즉 화학 반응 방정식에서 파생된 양에 대해 얻은 실제 생성물 양의 비율을 알아내는 데에도 사용됩니다.
예시 1.
30 kg의 황산(IV) 산화물을 산화 반응시켰고, 백금 촉매 존재하에 34 kg의 황산(VI) 산화물을 얻었다. 이 과정의 수율은 어떻습니까? 화학 반응식: ![]() 기록된 반응에서 우리는 2몰의 황산(IV) 산화물이 동일한 몰의 황산(VI) 산화물을 생성한다는 것을 알 수 있습니다. 반응물의 몰 질량을 알면 화학양론적으로 100%수율을 가정할 때 128g SO 2 가 160g SO 3 을 생성한다는 것을 알 수 있습니다. 이 지식을 바탕으로 비율을 정리할 수 있습니다: 0.128 kg SO 2 – 0.160 kg SO 3 30 kg SO 2 – x kg SO 3 여기에서 100%생산되는 황(VI) 산화물의 양을 알아낼 수 있습니다. 생산하다.
기록된 반응에서 우리는 2몰의 황산(IV) 산화물이 동일한 몰의 황산(VI) 산화물을 생성한다는 것을 알 수 있습니다. 반응물의 몰 질량을 알면 화학양론적으로 100%수율을 가정할 때 128g SO 2 가 160g SO 3 을 생성한다는 것을 알 수 있습니다. 이 지식을 바탕으로 비율을 정리할 수 있습니다: 0.128 kg SO 2 – 0.160 kg SO 3 30 kg SO 2 – x kg SO 3 여기에서 100%생산되는 황(VI) 산화물의 양을 알아낼 수 있습니다. 생산하다. 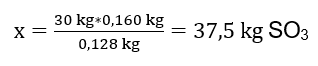 SO 3 의 이론적인 양과 실제 양을 알면 반응이 발생한 수율을 계산할 수 있습니다. 37.5kg SO 3 – 100%수율 34kg SO 3 – x%수율
SO 3 의 이론적인 양과 실제 양을 알면 반응이 발생한 수율을 계산할 수 있습니다. 37.5kg SO 3 – 100%수율 34kg SO 3 – x%수율 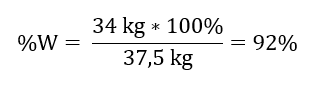 백금 촉매를 사용하여 황산(IV) 산화물을 황산(VI) 산화물로 산화하는 것은 92%수율로 발생했습니다.
백금 촉매를 사용하여 황산(IV) 산화물을 황산(VI) 산화물로 산화하는 것은 92%수율로 발생했습니다.
분자 및 원소 공식
화학양론적 계산의 또 다른 적용은 간단한 화합물의 공식을 결정하는 것입니다. 화합물의 분자식은 실험식과 동일하거나 정수배이다. 화합물의 일반식이 N x O y 임을 안다면, 화학양론적 지수의 값은 원자당 질량을 원자 질량으로 나누어 계산할 수 있습니다. 화합물의 분자량을 모르고 구성 비율만 알 수 있는 경우에는 원소식만 알 수 있습니다. 이는 분자식을 실제로 표현하거나 단순히 개별 요소의 비율을 결정할 수도 있습니다.
예시 1.
화합물의 분자량은 92u이고 질소 30.43%와 산소 69.57%로 구성되어 있습니다. 화합물의 분자식은 무엇입니까? 화합물에 존재하는 분자의 합은 100%이므로 다음과 같이 가정할 수 있습니다. 92 u – 100%이를 통해 개별 원소 함량을 계산할 수 있습니다. 92 u – 100%xu 질소 – 30.43%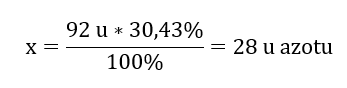 따라서 우리는 산소 원자당 질량이 다음과 같다는 것을 알고 있습니다: 92 u – 28 u = 64 u 원소의 개별 질량을 알면 화학양론적 지수를 결정할 수 있습니다.
따라서 우리는 산소 원자당 질량이 다음과 같다는 것을 알고 있습니다: 92 u – 28 u = 64 u 원소의 개별 질량을 알면 화학양론적 지수를 결정할 수 있습니다. 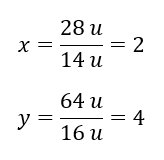 이 화합물의 분자식은 N 2 O 4 입니다.
이 화합물의 분자식은 N 2 O 4 입니다.
예시 2.
화합물에는 산소 60%와 황 40%라는 두 가지 요소가 있습니다. 그 원소 공식은 무엇입니까? 일반 공식은 S x O y 입니다. 여기서 x는 40%이고 y는 60%입니다. 개별 원소의 몰 질량을 알면 이는 다음과 같이 나타낼 수 있습니다. 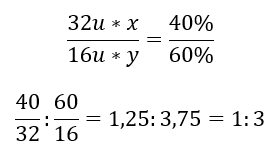 이는 주어진 화합물에 황 원자 하나당 산소 원자가 세 개 있다는 것을 의미합니다. 원소식은 SO 3 입니다.
이는 주어진 화합물에 황 원자 하나당 산소 원자가 세 개 있다는 것을 의미합니다. 원소식은 SO 3 입니다. 
과잉 및 제한 기질
반응물이 해당 화학량론과 다른 비율로 존재하는 반응의 경우, 반응물 중 하나가 완전히 반응하고 반응이 중단됩니다. 그런 다음 이는 제한 반응물의 형태로 존재하는 반면, 두 번째 반응물은 시스템에 과도하게 존재하며 반응이 완료된 후에도 여전히 1차 형태로 시스템에 존재합니다.
예시 1.
실험실에서 0.25M 황산알루미늄 용액 40cm3 를 0.5M 염화바륨 용액 50cm3 과 반응시켰다. 몇 그램의 침전물이 형성될 것인가? 화학 반응식: ![]() 실제 반응 과정을 아는 첫 번째 단계는 반응에 관련된 물질의 실제 몰수를 결정하는 것입니다. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0.25 · 0.04 dm 3 = 0.010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0.5 · 0.05 dm 3 = 0.025 mol 두 번째 단계는 반응의 화학양론에 기초하여 결핍 기질을 결정하는 것 – 이것은 형성된 침전물의 양을 결정합니다. 1mol Al 2 (SO 4 ) 3 – 3mol BaCl 2 0.010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
실제 반응 과정을 아는 첫 번째 단계는 반응에 관련된 물질의 실제 몰수를 결정하는 것입니다. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0.25 · 0.04 dm 3 = 0.010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0.5 · 0.05 dm 3 = 0.025 mol 두 번째 단계는 반응의 화학양론에 기초하여 결핍 기질을 결정하는 것 – 이것은 형성된 침전물의 양을 결정합니다. 1mol Al 2 (SO 4 ) 3 – 3mol BaCl 2 0.010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 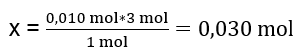 반응을 완전히 수행하려면 0.010mol Al 2 (SO 4 ) 3 을 가지고 시스템에 0.030mol BaCl 2 를 첨가해야 합니다. 그러나 염화바륨은 0.025mol만 반응하는데, 이는 부족하다는 의미이며 반응을 제한하게 됩니다. 따라서 반응에서 형성된 침전물의 양은 이 기질의 양으로부터 계산되어야 합니다. 반응의 화학량론에 따라 사용된 염화바륨의 몰수는 형성된 침전물의 몰수와 동일합니다. 따라서: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 바륨의 몰수 알기 m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0.025mol · 233.393 g/mol = 5.835g 과제에 주어진 반응과 기질의 양은 5.835g의 황산바륨 침전물을 생성합니다.
반응을 완전히 수행하려면 0.010mol Al 2 (SO 4 ) 3 을 가지고 시스템에 0.030mol BaCl 2 를 첨가해야 합니다. 그러나 염화바륨은 0.025mol만 반응하는데, 이는 부족하다는 의미이며 반응을 제한하게 됩니다. 따라서 반응에서 형성된 침전물의 양은 이 기질의 양으로부터 계산되어야 합니다. 반응의 화학량론에 따라 사용된 염화바륨의 몰수는 형성된 침전물의 몰수와 동일합니다. 따라서: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 바륨의 몰수 알기 m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0.025mol · 233.393 g/mol = 5.835g 과제에 주어진 반응과 기질의 양은 5.835g의 황산바륨 침전물을 생성합니다.
