"pH 완충제"라는 용어는 소량의 염기 또는 산을 도입하거나 희석하는 동안에도 pH 값이 변하지 않는 수용액을 의미합니다. 실질적으로 약산 용액과 그 염과 농축된 강염기(양성자 공여체-양성자 수용체)의 혼합물 또는 유사하게 약염기 용액과 그 염과 강산의 혼합물입니다. 완충용액을 사용하는 주된 목적은 pH 값을 상당히 안정적인 수준으로 유지할 수 있도록 하는 작용제 역할을 한다는 것입니다. 예를 들어 염료 제조, 발효 공정, 식품, 화장품 및 의약품의 pH 값 결정과 같은 광범위한 화학 응용 분야에서 자주 사용됩니다.
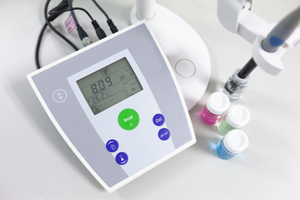
Henderson-Hasselbach 방정식
산 또는 염기에 각각 사용되는 pK a 또는 pK b 및 산과 그 짝염기 또는 유사하게 염기와 그 짝산의 농도 비율에 대한 완충액의 pH 값의 주요 의존성은 다음과 같습니다. Henderson-Hasselbach 방정식으로 정의됩니다. 적용된 산의 강도와 pH 값 사이의 상관 관계를 보여줍니다. 약산을 사용하여 생성된 버퍼의 샘플 반응의 경우 절차는 다음과 같습니다. HA + H 2 O ↔ H 3 O + + A – 반면 [A –] 간의 상관 관계는 몰 농도입니다. 짝염기 [mol ·dm -3], [HA], 해리되지 않은 산의 몰 농도 및 pK a – 산의 평형 해리 상수의 음의 로그 이러한 반응에 대한 Henderson-Hasselbach 방정식으로 표현되는 (K a )는 다음과 같은 형식을 갖습니다. 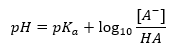
아세테이트 버퍼에 대한 Henderson-Hasselbach 방정식
버퍼의 작동 메커니즘은 수소 또는 수산화물 이온과 결합할 수 있는 이온의 존재를 기반으로 합니다. 아세트산과 아세트산 나트륨의 혼합물인 아세테이트 완충액을 고려할 때 약한 아세트산과 강한 전해질인 아세트산 나트륨(CH 3 COONa) 사이의 해리 반응을 기록해야 합니다. 이 반응은 이온으로 완전히 해리됩니다: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + 완충액은 이들 이온의 혼합물이므로 소량의 강산을 첨가하면 [H + } } 이온은 CH 3 COO – 음이온에 의해 즉시 결합되어 이러한 조건에서 해리되지 않는 아세트산을 형성합니다. 결과적으로 이것은 pH 값을 감소시킵니다. 같은 방식으로 용액에 강염기를 도입하여 추가 OH-양이온 을 공급해도 pH 수준이 증가하지 않습니다. 그들은 아세트산이 해리되지 않은 물 분자로 해리되어 발생하는 H + 이온에 의해 즉시 결합됩니다. 산 해리 상수를 정의하는 방정식은 다음과 같습니다. 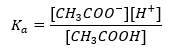 약한 아세트산의 해리에 대해, CH 3 COO – 음이온의 총 농도는 염의 해리에서 유래하는 이온의 농도로 정의되며, 이는 차례로 염의 농도(c s ), 그것은 아세트산 나트륨입니다. 이러한 음이온의 농도가 높으면 H + 양이온의 농도가 감소하여 결과적으로 산해리도가 감소하여 K a 값을 안정적으로 유지합니다. 이러한 관계로 인해 해리되지 않은 CH 3 COOH 분자의 수는 아세트산의 총 농도(c k )와 실질적으로 동일하다고 가정할 수도 있습니다. 이것이 해리상수를 다음과 같이 기록할 수 있는 이유입니다.
약한 아세트산의 해리에 대해, CH 3 COO – 음이온의 총 농도는 염의 해리에서 유래하는 이온의 농도로 정의되며, 이는 차례로 염의 농도(c s ), 그것은 아세트산 나트륨입니다. 이러한 음이온의 농도가 높으면 H + 양이온의 농도가 감소하여 결과적으로 산해리도가 감소하여 K a 값을 안정적으로 유지합니다. 이러한 관계로 인해 해리되지 않은 CH 3 COOH 분자의 수는 아세트산의 총 농도(c k )와 실질적으로 동일하다고 가정할 수도 있습니다. 이것이 해리상수를 다음과 같이 기록할 수 있는 이유입니다. 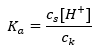 로그를 취한 후 Henderson-Hasselbach 방정식으로 이어지는 관계를 얻습니다.
로그를 취한 후 Henderson-Hasselbach 방정식으로 이어지는 관계를 얻습니다. 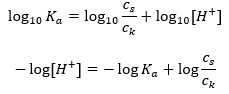 따라서 Henderson-Hasselbach 방정식의 형식은 다음과 같습니다.
따라서 Henderson-Hasselbach 방정식의 형식은 다음과 같습니다. 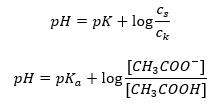 관계를 작성하기 위해 방정식의 pK a 값은 실제로 산의 강도를 측정한 것입니다. pK a 값이 3(-log(0.001))보다 낮으면 강산의 특징이며 값이 높을수록 약산입니다. Henderson-Hasselbach 방정식에서 나온 사실은 해리되지 않은 산의 농도와 해리에 의해 생성된 음이온의 농도의 비율이 되는 순간의 완충 용액의 pH 값과 산의 pK a 의 등가입니다. log(1)이 0이므로 산의 값은 1입니다. 완전한 중화에 필요한 양의 절반에 해당하는 양의 염기를 첨가하면 약산을 강염기로 적정한 결과 이러한 조건이 존재합니다. 산의. 그런 다음 용액 적정도는 50%입니다. pH와 사용된 적정제의 부피 사이의 의존성에서 버퍼 영역의 pH 값은 비교적 느리게 변합니다.
관계를 작성하기 위해 방정식의 pK a 값은 실제로 산의 강도를 측정한 것입니다. pK a 값이 3(-log(0.001))보다 낮으면 강산의 특징이며 값이 높을수록 약산입니다. Henderson-Hasselbach 방정식에서 나온 사실은 해리되지 않은 산의 농도와 해리에 의해 생성된 음이온의 농도의 비율이 되는 순간의 완충 용액의 pH 값과 산의 pK a 의 등가입니다. log(1)이 0이므로 산의 값은 1입니다. 완전한 중화에 필요한 양의 절반에 해당하는 양의 염기를 첨가하면 약산을 강염기로 적정한 결과 이러한 조건이 존재합니다. 산의. 그런 다음 용액 적정도는 50%입니다. pH와 사용된 적정제의 부피 사이의 의존성에서 버퍼 영역의 pH 값은 비교적 느리게 변합니다. 
예: 암모늄 버퍼
또 다른 유형의 버퍼는 약염기(NH 4 OH)와 강산(NH 4 Cl)의 혼합물인 암모늄 버퍼입니다. 그러나 메커니즘은 매우 유사합니다. 혼합물에 존재하는 염은 완전히 해리되며 그 상수는 다음 방정식입니다. 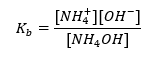 반면 암모늄 염기는 강한 전해질(NH 4 Cl)에서 실질적으로 해리되지 않습니다. 이러한 이유로 NH 4 + 양이온의 농도는 염의 농도와 동일하지만 해리되지 않은 NH 4 OH 분자의 농도는 염기의 농도와 동일하다고 가정합니다. 이를 통해 방정식을 공식화하고 해당 버퍼의 pH를 계산할 수 있습니다.
반면 암모늄 염기는 강한 전해질(NH 4 Cl)에서 실질적으로 해리되지 않습니다. 이러한 이유로 NH 4 + 양이온의 농도는 염의 농도와 동일하지만 해리되지 않은 NH 4 OH 분자의 농도는 염기의 농도와 동일하다고 가정합니다. 이를 통해 방정식을 공식화하고 해당 버퍼의 pH를 계산할 수 있습니다. 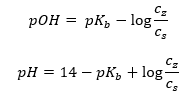 암모늄 완충액에 존재하는 NH 4 + 및 Cl – 이온과 NH 4 OH 분자는 일단 산이나 염기를 추가하면 다음 반응이 발생한다는 사실을 초래합니다. NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH 첨가량이 적으면 염기-염 농도비의 변화, 즉 pH의 변화도 작다. 이러한 농도의 비율이 10배 변하는 경우 pH 값은 1단위씩 변합니다.
암모늄 완충액에 존재하는 NH 4 + 및 Cl – 이온과 NH 4 OH 분자는 일단 산이나 염기를 추가하면 다음 반응이 발생한다는 사실을 초래합니다. NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH 첨가량이 적으면 염기-염 농도비의 변화, 즉 pH의 변화도 작다. 이러한 농도의 비율이 10배 변하는 경우 pH 값은 1단위씩 변합니다.
버퍼 용량
“완충 용량”이라는 용어는 용액의 산도를 거의 일정하게 유지하는 완충 용액의 용량을 의미합니다. 보다 정확하게는 1 dm 3 의 완충액에 첨가될 때 pH 값이 1씩 변하는 강산 또는 강염기의 그람 당량입니다. 완충 용량(β)을 정의하는 공식에는 완충 용액에 첨가한 후 강산/염기의 몰수(Δn, [ml])와 완충 용액에 대한 강산 또는 강염기의 부피(ΔpH). ![]() 이는 성분의 농도와 밀접한 관련이 있는 값으로 성분이 증가할수록 증가합니다. 완충 용량의 가장 높은 값은 pH가 이를 생산하는 데 사용된 산의 해리 상수(pK a )와 동일한 완충 용액을 특징으로 합니다.
이는 성분의 농도와 밀접한 관련이 있는 값으로 성분이 증가할수록 증가합니다. 완충 용량의 가장 높은 값은 pH가 이를 생산하는 데 사용된 산의 해리 상수(pK a )와 동일한 완충 용액을 특징으로 합니다.
인산염 완충액의 작동 원리
덜 인기있는 버퍼 유형은 두 가지 산성 염을 포함하는 버퍼입니다. 이 경우, 이들은 오르토인산(V) 산의 두 가지 산성 염, 즉 제1인산나트륨(V) 및 제2인산나트륨(V)입니다. 짝산-염기 쌍의 브뢴스테드 원리를 기반으로 하는 가장 일반적인 완충액과 달리 성분의 성질은 결정하기가 쉽지 않습니다. 인산염 완충액에 존재하는 음이온은 Brønsted 산의 특징적인 값을 나타내므로 이들 사이의 차이를 더 주의 깊게 확인해야 합니다. 그 원리에 따르면 더 강한 산인 이온은 더 높은 해리 상수를 가져야 합니다.
- H2PO4 의 경우 – Ka = 6.34· 10 -8
- HPO 4 -2 K a = 4.36·10 -13 의 경우
이러한 데이터를 사용할 수 있는 경우 이 경우 약한 Brønsted 산인 H 2 PO 4 -13 수소 음이온이라고 쉽게 말할 수 있습니다. 버퍼의 작동 메커니즘은 다음 방정식으로 표현될 수 있는 동적 평형을 기반으로 합니다. ![]() 완충 용액에 소량의 산을 첨가하면 시스템은 다음과 같이 수소 음이온을 양성자화하여 [H +] 양이온의 효과를 차단하는 반응으로 인한 pH 변화를 방지하려고 합니다. 방정식:
완충 용액에 소량의 산을 첨가하면 시스템은 다음과 같이 수소 음이온을 양성자화하여 [H +] 양이온의 효과를 차단하는 반응으로 인한 pH 변화를 방지하려고 합니다. 방정식: ![]() 용액에 첨가된 완충액을 중화시키는 것이 음이온이라는 사실은 음이온이 더 강한 Brønsted 염기라는 사실의 결과입니다. 이러한 시스템에서 우리는 Brønsted 산이 강할수록 짝염기가 약하다는 규칙을 적용합니다. 여러 Brønsted 염기를 포함하는 시스템에 산을 추가하면 가장 강한 염기가 가장 먼저 반응합니다. 이 관계는 Brønsted 산의 혼합물과 약한 Brønsted 염기의 혼합물로 구성된 완충 수용액의 혼합물에 존재하는 평형을 분석할 때 가장 중요한 구성 요소입니다. 동일한 규칙이지만 역순으로 인산염 완충액에 염기성 용액을 추가할 때 적용됩니다. OH – 음이온은 버퍼에 존재하는 더 강력한 Brønsted 산에 거의 즉시 포획됩니다. 이 경우 이것은 이온이 되며 반응은 다음 방정식에 따라 발생합니다.
용액에 첨가된 완충액을 중화시키는 것이 음이온이라는 사실은 음이온이 더 강한 Brønsted 염기라는 사실의 결과입니다. 이러한 시스템에서 우리는 Brønsted 산이 강할수록 짝염기가 약하다는 규칙을 적용합니다. 여러 Brønsted 염기를 포함하는 시스템에 산을 추가하면 가장 강한 염기가 가장 먼저 반응합니다. 이 관계는 Brønsted 산의 혼합물과 약한 Brønsted 염기의 혼합물로 구성된 완충 수용액의 혼합물에 존재하는 평형을 분석할 때 가장 중요한 구성 요소입니다. 동일한 규칙이지만 역순으로 인산염 완충액에 염기성 용액을 추가할 때 적용됩니다. OH – 음이온은 버퍼에 존재하는 더 강력한 Brønsted 산에 거의 즉시 포획됩니다. 이 경우 이것은 이온이 되며 반응은 다음 방정식에 따라 발생합니다. ![]()
알려진 버퍼 및 해당 응용 프로그램
- 혈액은 7.35와 7.45 단위의 값을 유지하며, 주로 용해된 이산화탄소와 중탄산염의 형태인 탄산의 존재에 의해 안정성이 보장됩니다. 과도한 양의 산 또는 염기는 인간의 생명에 위험한 상태를 유발할 수 있습니다. 버퍼의 유사한 예는 pH가 약 7인 타액입니다.
- 암모늄, 아세테이트, 인산염 및 붕산염 완충액, 그래서 각각:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH3COOH + CH3COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
널리 사용되는 모든 버퍼는 pH를 일정한 수준으로 유지하는 것이 중요한 곳에 적용됩니다. 예를 들면 다음과 같습니다.
- 의학에서 위독한 상태의 환자에게 정맥 주사로 투여됩니다.
- 토양의 반응이 중요한 요소인 미생물 배양에서;
- 효소 및 단백질과 함께 작업할 때 화학 반응을 위한 환경을 안정화합니다.
- 전극 근처 영역에서 pH의 빠르고 중요한 변화를 방지할 수 있으므로 전해조에 사용되는 전기도금;
- pH 측정기 교정용.
