Mengikut definisi, aktiviti kimia ialah keupayaan unsur untuk menderma elektron dalam tindak balas kimia. Dalam amalan, aktiviti mereka meningkat dengan penurunan elektronegativiti - ukuran keupayaan unsur untuk menarik elektron. Jika logam tidak menarik elektron dengan kuat, ia lebih reaktif. Unsur rujukan, hidrogen, digunakan untuk mengklasifikasikan aktiviti kimia logam. Ukuran aktiviti logam ialah keupayaannya untuk menyesarkan hidrogen daripada asid atau hidrogen daripada molekul air.

Siri aktiviti kimia logam
Istilah ini digunakan untuk menerangkan ringkasan unsur kimia yang bersifat logam , dalam susunan tertentu daripada yang paling kurang kepada yang paling aktif secara kimia. Ini digunakan untuk membandingkan aktiviti logam yang berbeza. Selain logam, siri aktiviti kimia juga termasuk satu bukan logam, hidrogen , yang merupakan unsur rujukan. Semakin tinggi dalam siri aktiviti logam, semakin reaktif ia . Ia juga berkaitan dengan fakta bahawa ia lebih mudah teroksida dan oleh itu merupakan reduktor yang lebih kuat dan unsur yang lebih aktif secara kimia. Sebaliknya, semakin rendah dalam siri aktiviti logam diletakkan, semakin kurang reaktifnya. Ini bermakna ia mengalami tindak balas pengurangan dengan lebih mudah dan oleh itu merupakan oksidan yang lebih kuat, unsur yang kurang aktif. Menggunakan nilai yang ditunjukkan dalam Jadual 1, kita dapat melihat bahawa semakin rendah nilai potensi piawai sesuatu unsur, semakin kuat reduktor dan semakin reaktif secara kimia logam tersebut. Ukuran keupayaan untuk menderma elektron dalam pelbagai aktiviti logam ialah nilai potensi piawainya . Untuk hidrogen, atau lebih tepatnya elektrod hidrogen, potensi piawai diandaikan sifar. Potensi piawai ialah daya gerak elektrik bagi sel yang terdiri daripada separuh sel hidrogen standard dan separuh sel yang lain di mana kepekatan substrat dan produk ialah 1 mol/dm 3 .
| Elektrod | Potensi standard [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2.86 |
| Mg/Mg 3+ | -2.36 |
| Al/Al 3+ | -1.69 |
| Mn/Mn 2+ | -1.18 |
| Zn/Zn 2+ | -0.76 |
| Cr/Cr 3+ | -0.74 |
| Fe/Fe 2+ | -0.44 |
| Cd/Cd 2+ | -0.40 |
| Co/Co 2+ | -0.28 |
| Ni/Ni 2+ | -0.26 |
| Sn/Sn 2+ | -0.14 |
| Pb/Pb 2+ | -0.14 |
| Fe/Fe 3+ | 0.04 |
| H 2 /2H + | 0.00 |
| Bi/Bi 3+ | +0.32 |
| Cu/Cu 2+ | +0.34 |
| Ag/Ag + | +0.80 |
| Hg/Hg 2+ | +0.85 |
| Au/Au 3+ | +1.52 |
Jadual 1 . Siri elektrokimia logam Logam yang kelihatan di bahagian atas siri adalah yang paling aktif. Hidrogen di atas cenderung mudah teroksida dan oleh itu merupakan agen penurunan yang lebih kuat daripada hidrogen. Unsur-unsur di bawah hidrogen dalam siri ini lebih mudah dikurangkan dan merupakan pengoksida yang lebih kuat. Jika logam mempunyai potensi yang lebih negatif daripada yang lain, ini bermakna ia akan menggantikannya daripada garamnya. Sebagai contoh, besi akan menyesarkan kuprum dalam garam kuprum, tetapi kuprum tidak akan menyesarkan besi daripada garamnya. Sebaliknya, ia boleh menggantikan perak daripada garam perak. Litium dan berilium daripada larutan garam logam lain tidak menggantikannya, tetapi bertindak balas secara langsung dengan air. Mereka menggantikan hidrogen dan menghasilkan sebatian – hidroksidanya . Logam sedemikian dipanggil logam aktif. Aktiviti logam dan jadual berkala unsur Seperti banyak sifat lain, aktiviti kimia sesuatu unsur boleh disimpulkan daripada kedudukannya dalam jadual berkala . Logam yang paling aktif adalah dalam kumpulan I dan II, kerana ia mudah menyesarkan hidrogen daripada air untuk membentuk hidroksida. Dalam kumpulan, aktiviti kimia logam meningkat dengan peningkatan nombor atom . Tempoh berkurang apabila nombor atom bertambah. 
Logam berharga dan asas
Hidrogen bukan sahaja menyediakan titik rujukan aktiviti, tetapi juga memisahkan logam berharga dan asas dalam siri . Logam asas adalah yang di atas hidrogen. Masing-masing bertindak balas dengan asid, menyesarkan hidrogen daripadanya. Dari kalium kepada kalsium mereka bertindak balas dengan air yang sudah berada pada suhu bilik, dan dari magnesium kepada besi mereka bertindak balas dengannya pada suhu tinggi. Semua logam yang berada di bawah hidrogen dalam siri aktiviti tidak menyesarkan hidrogen daripada asid . Walau bagaimanapun, ia boleh bertindak balas dengan asid pengoksidaan untuk membentuk garam dan oksida yang sepadan, yang terbentuk dengan mengurangkan sisa asid. Unsur-unsur di bahagian bawah siri ini, daripada perak hingga emas, sangat tahan terhadap tindak balas kimia sehingga ia hanya bertindak balas dengan aqua regia . Larutan sedemikian ialah campuran larutan pekat asid hidroklorik dan larutan pekat asid nitrik (V) , dicampur dalam nisbah isipadu 3:1. Mengetahui fakta-fakta ini, kita boleh menyimpulkan bahawa beberapa tindak balas boleh dijalankan untuk membezakan aktiviti unsur: dengan air pada suhu bilik, dengan air panas, dengan asid bukan pengoksida, dengan asid pengoksida dan dengan aqua regia.
Eksperimen untuk mengesan logam yang menyesarkan hidrogen daripada asid
Cara paling mudah untuk mengesahkan aktiviti logam adalah dengan menjalankan eksperimen. Untuk melakukan ini, sepuluh tabung uji perlu disediakan di mana perkara berikut akan diletakkan berturut-turut: dalam 1-5: reben magnesium, dawai zink, dawai besi, dawai nikel dan dawai tembaga. Urutan yang sama harus diulang dalam tiub 6-10. Tambah beberapa mililiter asid hidroklorik ke dalam tiub 1-5 dan beberapa mililiter asid sulfurik cair (VI) ke dalam tiub 6-10. Sapukan splint yang terbakar pada setiap tiub. Dalam tabung uji yang mengandungi reben magnesium dan wayar besi, zink dan nikel, dibanjiri dengan asid, gelembung gas dipancarkan. Pelepasan yang paling sengit boleh diperhatikan dalam tiub yang mengandungi magnesium. Reaksi yang berlaku adalah seperti berikut: 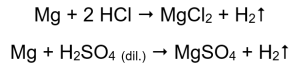 Jumlah gas yang dipancarkan berkurangan dalam siri: zink, besi, nikel. Reaksi berikut berlaku dengan sewajarnya:
Jumlah gas yang dipancarkan berkurangan dalam siri: zink, besi, nikel. Reaksi berikut berlaku dengan sewajarnya:  Dalam tiub yang mengandungi wayar tembaga, tiada gas yang kelihatan, tiada perubahan. Ini bermakna tindak balas sedemikian tidak berlaku:
Dalam tiub yang mengandungi wayar tembaga, tiada gas yang kelihatan, tiada perubahan. Ini bermakna tindak balas sedemikian tidak berlaku: 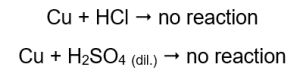 Apabila splint terbakar digunakan, bunyi tersendiri kedengaran di dalam tiub dari mana gas dikeluarkan.
Apabila splint terbakar digunakan, bunyi tersendiri kedengaran di dalam tiub dari mana gas dikeluarkan.
Ringkasan pemerhatian dan kesimpulan:
Magnesium, zink, besi dan nikel bertindak balas dengan kedua-dua asid hidroklorik dan asid sulfurik (VI). Masing-masing menyesarkan hidrogen daripada asid, yang bermaksud bahawa mereka lebih tinggi dalam siri aktiviti logam daripada asid. Tindak balas menghasilkan produk dalam bentuk garam dan gas, hidrogen, yang dibebaskan. Bunyi tersendiri yang mengiringi penggunaan splin bercahaya pada tabung uji gas yang terlepas disebabkan oleh tindak balas hidrogen dengan oksigen. Daripada semua logam yang diuji, magnesium adalah yang paling reaktif, diikuti oleh zink, besi, nikel dan kuprum. Kita boleh tahu kerana keamatan gelembung gas menunjukkan aktiviti logam. Tiada perubahan diperhatikan dalam tiub yang mengandungi kuprum. Ini menunjukkan bahawa kuprum tidak dapat menggantikan hidrogen daripada sama ada asid hidroklorik atau asid sulfurik (VI) cair.
