Dari segi struktur kimia, alkana tergolong dalam kumpulan hidrokarbon. Sebatian ini mengandungi hanya dua jenis atom: karbon dan hidrogen. Ia terdiri daripada rangka kerja karbon asas yang dikaitkan dengan atom hidrogen. Alkana hanya mempunyai ikatan tunggal, itulah sebabnya ia dipanggil hidrokarbon tepu.

Siri homolog
Disusun oleh jumlah atom hidrogen yang semakin meningkat dalam strukturnya, wakil alkana membentuk siri homolog. Ia bermula dengan metana, mengandungi satu atom karbon, dan berakhir dengan dekana dengan sembilan atom karbon. Nama-nama alkana berasal daripada jumlah atom karbon yang wujud dalam struktur dan ditakrifkan dengan angka Yunani atau Latin serta ciri akhiran -ana, seperti dengan heptana, nona, dll. Formula umum untuk alkana adalah seperti berikut: , di mana ‘n’ bermaksud nombor karbon (C) yang terdapat dalam rantai dan ‘H’ mewakili atom hidrogen.
| Bilangan atom karbon yang terdapat dalam rantai | Formula alkana | nama alkana |
| 1 | CH 4 | Metana |
| 2 | C 2 H 6 | Ethane |
| 3 | C 3 H 8 | propana |
| 4 | C 4 H 10 | Butana |
| 5 | C 5 H 12 | Pentane |
| 6 | C 6 H 14 | Heksana |
| 7 | C 7 H 16 | Heptana |
| 8 | C 8 H 18 | oktana |
| 9 | C 9 H 20 | Nonane |
| 10 | C 10 H 22 | Decane |
Jenis hidrokarbon tepu
Dari segi struktur rantai, kami membezakan jenis alkana berikut:
-
Alkana linear (parafin).
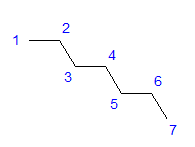 Rajah 1 Formula struktur heptana Semua atom karbon menunjukkan penghibridan sp 3 . Oleh kerana sudut tetragon antara ikatan, susunan atom karbon berbentuk zigzag diperlukan. Molekul mungkin mengambil pelbagai susunan, kerana putaran bebas mungkin di sekeliling ikatan tunggal antara atom karbon. Lebih tinggi nombor karbon dalam struktur, lebih pelbagai bentuk rantai mungkin.
Rajah 1 Formula struktur heptana Semua atom karbon menunjukkan penghibridan sp 3 . Oleh kerana sudut tetragon antara ikatan, susunan atom karbon berbentuk zigzag diperlukan. Molekul mungkin mengambil pelbagai susunan, kerana putaran bebas mungkin di sekeliling ikatan tunggal antara atom karbon. Lebih tinggi nombor karbon dalam struktur, lebih pelbagai bentuk rantai mungkin.
-
Isoalkana: hidrokarbon tepu bercabang
Pembentukan hidrokarbon bercabang adalah kesan penghubung antara atom karbon dan lebih daripada dua atom karbon lain. Cawangan terbentuk pada titik pautan sedemikian. Hidrokarbon bercabang ialah isomer hidrokarbon linear. 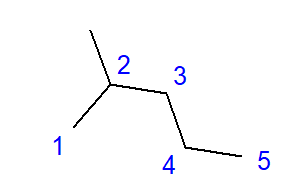 Rajah 2 Formula struktur untuk 2-metilpentana Formula untuk 2-metilpentana yang ditunjukkan dalam Rajah 2 mempunyai sejumlah enam atom karbon dan merupakan isomer heksana. Nama ‘2-metilpentana’ bermaksud rantai pentana mempunyai kumpulan metil yang dipautkan pada kedudukan atom karbon kedua. Bilangan isomer struktur yang mungkin bertambah bersama dengan bilangan karbon yang semakin meningkat. Sebagai contoh, heksana boleh mempunyai struktur 5 isomer berbeza, oktana mempunyai 18 kemungkinan sedemikian, dan heksana sebanyak 75.
Rajah 2 Formula struktur untuk 2-metilpentana Formula untuk 2-metilpentana yang ditunjukkan dalam Rajah 2 mempunyai sejumlah enam atom karbon dan merupakan isomer heksana. Nama ‘2-metilpentana’ bermaksud rantai pentana mempunyai kumpulan metil yang dipautkan pada kedudukan atom karbon kedua. Bilangan isomer struktur yang mungkin bertambah bersama dengan bilangan karbon yang semakin meningkat. Sebagai contoh, heksana boleh mempunyai struktur 5 isomer berbeza, oktana mempunyai 18 kemungkinan sedemikian, dan heksana sebanyak 75.
-
Hidrokarbon kitaran: sikloalkana, hidrokarbon alisiklik
Adalah mungkin untuk menutup struktur rantai semasa membentuk cincin yang terdiri daripada unsur –CH 2 – berulang. Nama-nama tersebut berdasarkan nama alkana dengan awalan ‘siklo-‘, seperti siklobutana atau sikloheptana. Untuk menjadikannya lebih mudah, mereka boleh dibentangkan sebagai poligon biasa. 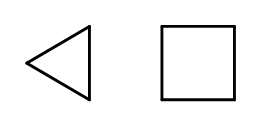 Rajah 3 Dari kiri: cyclopropane, cyclobutane Terdapat juga gelang pengganti, yang namanya termasuk substituen. Dalam kes ini, bilangan atom karbon direka bentuk sedemikian rupa sehingga lokasi substituen mungkin rendah.
Rajah 3 Dari kiri: cyclopropane, cyclobutane Terdapat juga gelang pengganti, yang namanya termasuk substituen. Dalam kes ini, bilangan atom karbon direka bentuk sedemikian rupa sehingga lokasi substituen mungkin rendah.
Wakil yang paling penting
Metana ialah sebatian dengan formula molekul CH 4 , memulakan siri homolog alkana. Karbon adalah tetravalen, jadi ia mempunyai empat ikatan CH. Pada suhu bilik, ia adalah gas tidak berbau dan tidak berwarna. Oleh kerana atom karbon menunjukkan penghibridan sp 3 , ia berstruktur sebagai tetrahedron, dan orbital yang dihasilkan membentuk ikatan setara bersama-sama dengan empat atom hidrogen. Etana ialah alkana seterusnya dalam siri ini, yang formula molekulnya ialah C 2 H 6 . Apabila melihat formula separa struktur H 3 C-CH 3 , kita akan melihat bahawa setiap atom karbon dikaitkan dengan tiga atom hidrogen. Sama seperti metana dan hidrokarbon rendah lain, ia adalah gas tidak berwarna dan tidak berbau. Ikatan CH ialah ikatan sp-s sigma hadapan, manakala ikatan tunggal antara atom karbon ialah ikatan sp-sp sigma hadapan.
Sintesis alkana
- Penghidrogenan alkena atau alkuna

- Hidrolisis sebatian Grignard
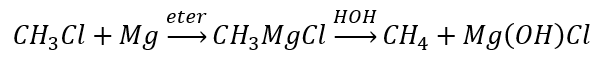
- Pengurangan alkil halida
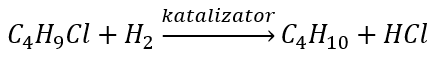
- Reaksi Wurtz
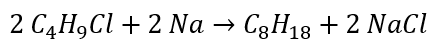
Pengurangan aldehid dan keton
- Pengurangan Clemmensen
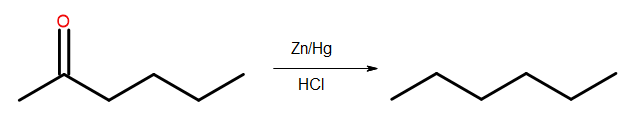 Rajah 4 Diagram pengurangan Clemmensen
Rajah 4 Diagram pengurangan Clemmensen
- Reaksi Wolff-Kishner
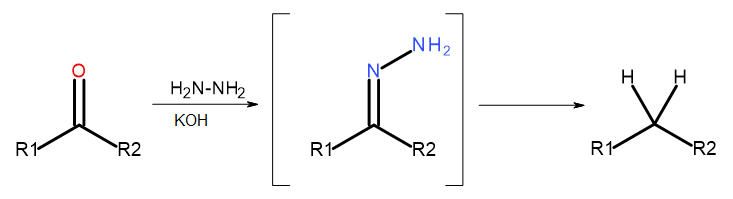 Rajah 5 Diagram Wolff-Kishner
Rajah 5 Diagram Wolff-Kishner
Sifat fiziko-kimia alkana
Alkana berantai pendek dari C 1 hingga C 4 pada suhu bilik adalah gas. Homolog lain (bermula dari pentana) ialah cecair dengan takat didih yang semakin meningkat. Cawangan yang terdapat dalam struktur menghasilkan takat didih isomer yang lebih rendah. Kebergantungan menambah satu lagi kumpulan –CH 2 – dalam struktur meningkatkan takat didih sekitar 20–30 o C lebih tinggi bersama-sama dengan menambah panjang rantai karbon. Keadaan pengagregatan alkana dari oktadekana ke atas adalah pepejal dengan takat lebur bermula dari 28 o C untuk n-octadecane. Hidrokarbon pepejal termasuk parafin, manakala hidrokarbon cecair yang lebih tinggi termasuk minyak parafin. Oleh kerana sifat hidrofobiknya, molekul alkana tidak bercampur dengan air, tidak dibasahi oleh air, dan tidak larut dalam air. Walau bagaimanapun, dengan pertalian mereka dengan ciri bukan kutub, ia mudah larut dalam diri mereka sendiri dan dalam pelarut organik bukan kutub, sederhana dan kutub rendah yang serupa. Keterlarutan alkana dalam dua pelarut alkohol yang popular (metanol dan etanol) adalah agak baik. Dalam metanol, alkana larut dengan baik hanya sehingga kepekatan tertentu. Lebihan kepekatan itu menyebabkan fasa terpisah. Dalam etanol, alkana yang lebih rendah larut dengan sangat mudah, manakala ia agak sukar untuk melarutkan alkana yang lebih tinggi. Hidrokarbon yang lebih tinggi adalah bahan mudah terbakar. Hidrokarbon gas serta sepasang hidrokarbon cecair membentuk campuran dengan potensi letupan apabila bercampur dengan udara. Kereaktifan alkana agak rendah kerana kekurangan kumpulan berfungsi yang berpotensi reaktif. Ikatan antara atom karbon (CC) dan juga antara atom karbon dan oksigen (CH) sangat tahan terhadap pembelahan. Tenaga ikatan ini ialah 88 kcal/mol dan 104 kcal/mol, masing-masing. Mereka mungkin bertindak balas secara mendadak hanya dalam keadaan tertentu.
Tindak balas alkana
- Pembakaran lengkap – dengan pelepasan karbon dioksida
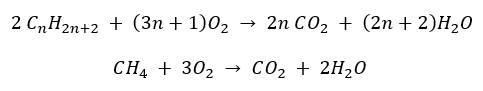
- Separa pembakaran – dengan oksigen terhad dan pelepasan karbon monoksida
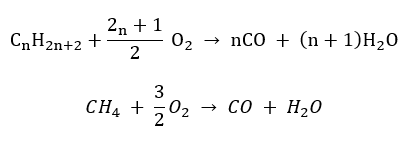
- Pembakaran tidak lengkap – karbon hitam terbentuk dengan jumlah oksigen yang sangat terhad
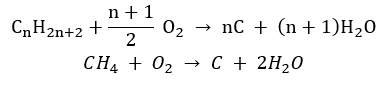
- Tindak balas penggantian (halogenasi radikal, dicontohkan oleh tindak balas metana dengan klorin dengan penyertaan cahaya)
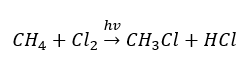
- Pirolisis ialah penguraian alkana kepada molekul yang lebih kecil pada suhu yang sangat tinggi. Bergantung pada proses, keretakan, hidro-rekahan atau isomerisasi mungkin berlaku.
- Nitrasi dengan penggunaan asid nitrik(V) dan pembentukan campuran produk: isomer dengan substituen –NO 2 di pelbagai lokasi.
- Sulfonasi dua peringkat, di mana mersol adalah produk perantaraan dan mersolan adalah produk akhir.
