Alkena ialah hidrokarbon tak tepu, yang, seperti alkana, membentuk siri homolog. Walau bagaimanapun, tidak seperti alkana, alkena mempunyai satu ikatan berganda - ikatan berganda - antara atom karbon. Selebihnya adalah ikatan tunggal, tetapi kejadian walaupun satu ikatan berganda dalam molekul menjadikan hidrokarbon sebagai sebatian tak tepu.

Struktur alkena
Ikatan CC antara atom dalam hidrokarbon tepu menyebabkan setiap daripadanya mempunyai hibridisasi sp 3 . Dalam alkena, yang mempunyai ikatan C=C, berlaku penghibridan sp 2 . Sifat ini menyebabkan struktur sebatian dengan ikatan berganda menjadi bentuk trigonal. Ikatan 3 sigmanya berada dalam satah yang sama dan menghadap sudut segi tiga sama sisi, yang pusatnya ialah atom karbon. Sebaliknya, ikatan pi terhasil daripada pertindihan orbital p bukan hibrid dalam arah yang berserenjang dengan segitiga, yang terbentuk daripada orbital hibrid dan orbital simetri yang serupa bagi atom jiran. Pembinaan kumpulan yang paling mudah, dan sebatian pertama dalam siri homolog alkena, ialah etena. Metana, sebatian yang pertama daripada alkana, tidak dapat membentuk ikatan berganda.
Contoh struktur alkena
Mari kita ambil sebatian paling mudah kumpulan itu, etena, dan periksa strukturnya. Kita tahu bahawa atom karbon dalam molekul etena mempunyai hibridisasi sp 2 , jadi molekul itu rata. Sudut antara ikatan dalam susun atur ini ialah 120 o . Empat ikatan antara atom karbon dan hidrogen yang terdapat dalam struktur CH ialah ikatan sigma δ SP-s dengan tumpang tindih kepala. Terdapat juga ikatan homonuklear yang terbentuk antara atom karbon. Satu ialah CC δ sp-sp dan satu lagi ialah CC π pp , yang terbentuk daripada orbital p bukan hibrid.
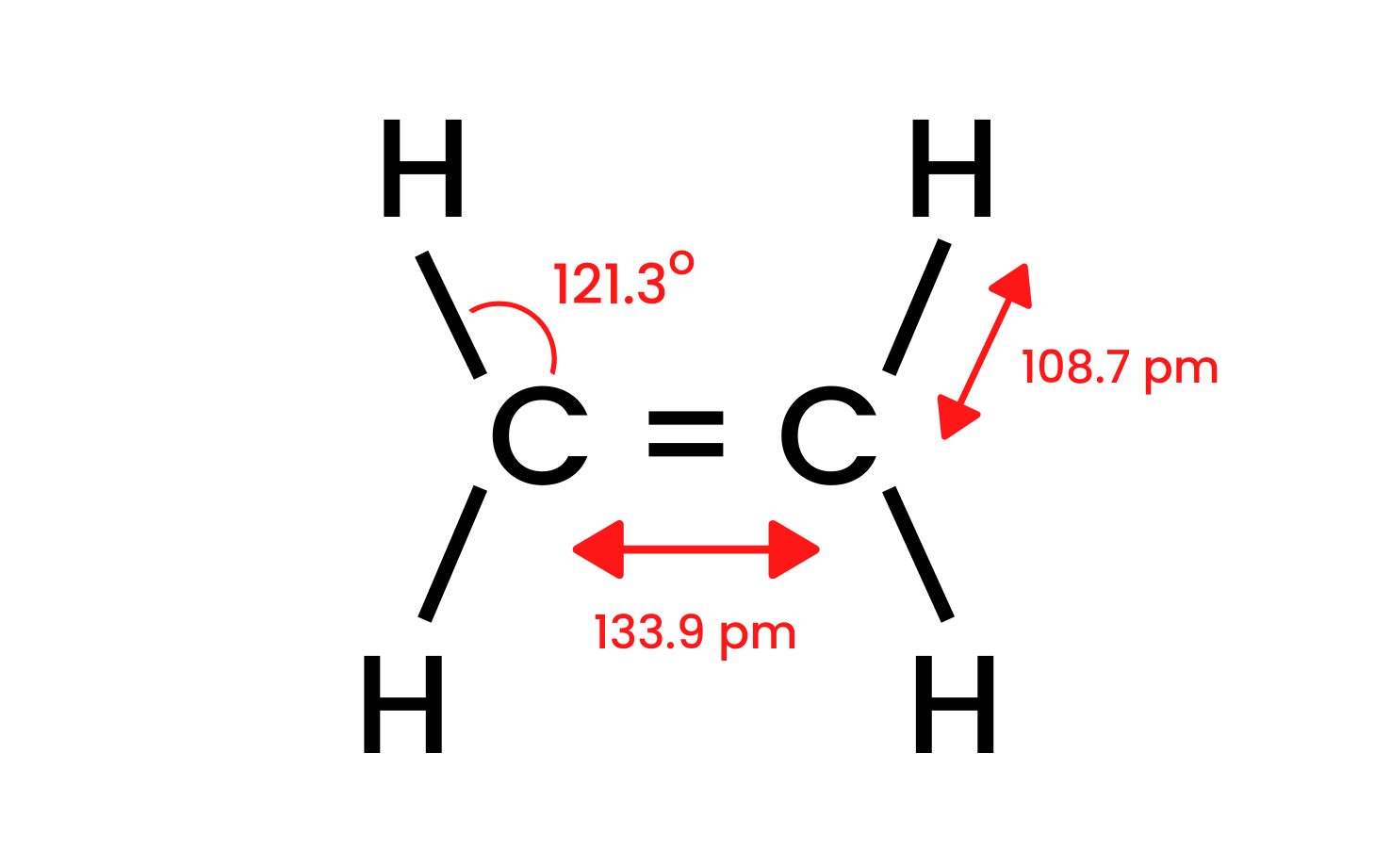
Rajah 1. Struktur etena
Siri homolog alkena
Siri homolog ialah sekumpulan sebatian kimia yang mempunyai struktur dan sifat kimia yang hampir sama. Bahan tersebut juga boleh ditulis dengan formula molekul biasa. Formula am untuk alkena boleh ditulis sebagai C n H 2n . Secara struktur, ia kelihatan seperti ini:
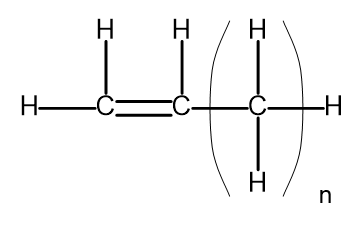
Rajah 2. Formula struktur am untuk alkena
| Bilangan atom karbon dalam rantai | Formula alkana | nama alkana | Formula alkena | nama alkena |
| 2 | C 2 H 6 | Ethane | C 2 H 4 | Etena |
| 3 | C 3 H 8 | propana | C 3 H 6 | Propena |
| 4 | C 4 H 10 | Butana | C 4 H 8 | Butene |
| 5 | C 5 H 12 | Pentane | C 5 H 10 | Pentene |
| 6 | C 6 H 14 | Heksana | C 6 H 12 | Heksena |
| 7 | C 7 H 16 | Heptana | C 7 H 14 | Heptena |
| 8 | C 8 H 18 | oktana | C 8 H 16 | Oktena |
| 9 | C 9 H 20 | Nonane | C 9 H 18 | Tiada |
| 10 | C 10 H 22 | Decane | C 10 H 20 | Decene |
Sebatian daripada butena hingga desen mungkin mempunyai cawangan pada lokasi atom karbon yang sama, jadi ia juga boleh dipanggil but-1-ene, hept-1-ene atau dec-1-ene. Ini bermakna ikatan tak tepu terdapat di antara atom karbon yang memulakan rantai. Fenomena pelbagai kemungkinan penempatan ikatan berganda tak tepu dipanggil isomerisme kedudukan. Sebagai contoh, sebatian dengan formula molekul C 7 H 14 mempunyai beberapa isomer kedudukan yang mungkin. Ikatan berganda dalam strukturnya boleh didapati, contohnya, pada atom karbon nombor satu dan tiga, seperti yang ditunjukkan dalam Rajah 3.
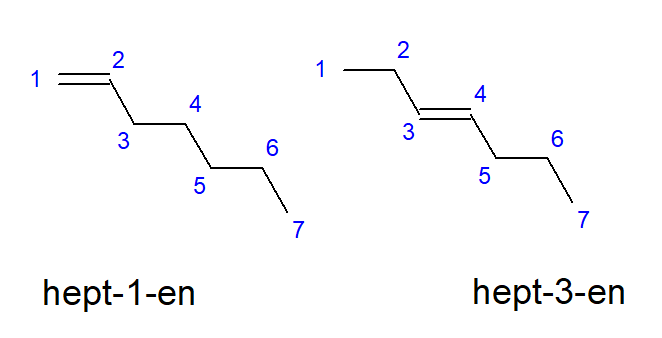
Rajah 3. Formula struktur hept-1-ene (1-heptene) dan hept-3-ene (3-heptene)
Struktur alkena – ringkasan
Setiap alkena mempunyai ikatan pi berganda (π) di mana struktur rata dicipta. Atom karbon mempunyai hibridisasi sp 2 , dicirikan oleh bentuk trigonal. Di lokasi tepu, kumpulan –CH 2 – metilena boleh mencipta rantai lurus dan bercabang yang berkembang secara ruang. Putaran berlaku hanya di sekitar ikatan tunggal, dan tidak berlaku dalam kes ikatan C=C. Sifat fizikal dan kimia asas kumpulan alkena Alkena mempunyai sifat hidrofobik dan oleh itu mempunyai sifat bukan kutub. Mereka memasuki tindak balas dengan air. Kerana pertalian mereka, mereka larut dengan baik dalam pelarut bukan polar seperti alkana. Takat lebur, takat didih dan ketumpatan alkena meningkat apabila bilangan atom karbon dalam molekul bertambah. Aktiviti mereka adalah yang terbesar dalam alkena rantai pendek.
Mendapatkan alkena
Terdapat beberapa cara untuk mendapatkan alkena. Setiap cara ini adalah berdasarkan penghapusan dua substituen pada satu ikatan, seperti yang ditunjukkan pada rajah:
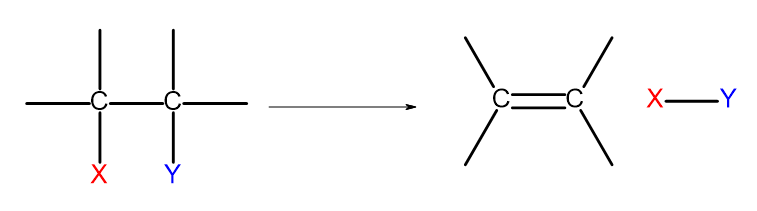
Rajah 4. Gambar rajah proses penyingkiran yang menghasilkan pembentukan alkena
Mendapatkan etena
1. Penyahhidrogenan alkana 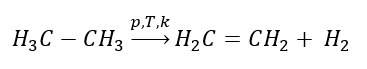 2. Dehidrasi alkohol
2. Dehidrasi alkohol 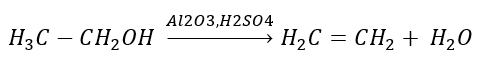 3. Tindak balas halogen-alkana dengan bes yang kuat
3. Tindak balas halogen-alkana dengan bes yang kuat 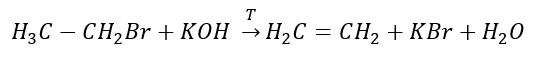 4. Tindak balas dihalogen-alkana dengan habuk zink
4. Tindak balas dihalogen-alkana dengan habuk zink 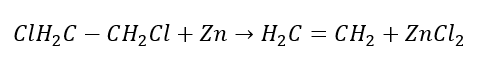 5. Penghidrogenan alkuna
5. Penghidrogenan alkuna 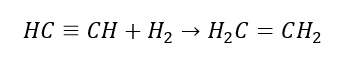
Tindak balas kimia alkena
Serpihan khusus zarah, yang pada masa yang sama mentakrifkan sifat dan gabungannya, dipanggil kumpulan berfungsi. Bagi alkena, kumpulan ini ialah ikatan berganda (C=C). Ikatan pi (π) yang terkandung di dalamnya sangat mudah terputus. Berbanding dengan elektron ikatan sigma, elektron yang menduduki orbital pi adalah lebih jauh daripada atom karbon dan oleh itu kurang dikaitkan dengannya. Ini menghasilkan mobiliti yang lebih besar dan ketersediaan yang lebih besar untuk mendekati reagen, menghasilkan kereaktifan kimia yang tinggi bagi ikatan. Terdapat beberapa jenis tindak balas mengikut mana alkena diubah. Ini adalah: penambahan elektrofilik, penambahan radikal bebas, pengoksidaan dan pengurangan, pempolimeran, dan penggantian allylic.
Penambahan elektrofilik
Kerana sifat elektron ikatan pi, agen yang menyerangnya mempunyai watak elektropositif. Molekul sedemikian adalah reagen elektrofilik yang mempunyai pertalian tinggi untuk elektron. Dalam kebanyakan kes, faktor ini ialah proton asal asid, jurang elektron, atau molekul yang mudah terpolarisasi akibat berdekatan dengan elektron pi. Penambahan, iaitu, tindak balas sambungan, mengikut mekanisme ion. Ini adalah mekanisme dua langkah di mana reagen elektrofilik yang mula-mula menghampiri menangkap elektron ikatan pi dengan penciptaan ikatan tunggal dan pembentukan karbokation sementara. Molekul yang sangat reaktif ini dengan pantas menyerang reagen lain yang mempunyai keupayaan untuk saling menyatukan elektron. Contoh tindak balas tersebut ialah penambahan klorin atau bromin kepada alkena. Hidrogen juga boleh ditambah (hidrogenisasi) dengan cara penambahan, tetapi ia bukan elektrofilik.
Tindak balas penambahan radikal bebas
Banyak tindak balas alkena menunjukkan ketidakpatuhan terhadap peraturan Markovnikov. Mekanisme mereka memberi tumpuan kepada tindak balas elektron ikatan pi kepada radikal bebas, di mana ikatan zarah penyerang karbon dihasilkan. Hasil daripada perubahan ini, radikal bebas baru diperoleh, yang mempunyai elektron tidak berpasangan pada atom karbon jiran.
Penggantian Allylic
Sebagai tambahan kepada tindak balas yang melibatkan ikatan berganda, alkena juga boleh bertindak balas dengan cara yang serupa dengan alkana dalam kumpulan alkil yang berdekatan. Contoh tindak balas sedemikian ialah penggantian atom hidrogen dengan halogen pada atom di sebelah atom karbon yang membentuk ikatan berganda. Tindak balas ini tidak menjejaskan bahagian struktur yang tidak tepu.
