Keelektronegatifan ialah kuantiti yang mencerminkan kecenderungan atom tertentu dalam molekul untuk menarik elektron ke arah dirinya. Dalam amalan, ia adalah keupayaan atom atau kumpulan berfungsi untuk menarik ketumpatan elektron. Skala yang paling biasa digunakan yang dikaitkan dengan kuantiti ini ialah skala yang diperkenalkan oleh Linus Pauling, yang memungkinkan untuk mengira sifat anggaran bon dengan mudah.

Ciri-ciri keelektronegatifan
Molekul homonuklear, contohnya H 2 dan O 2 , mempunyai pekali yang sama c A dan c B dalam orbital molekulnya, yang boleh direkodkan sebagai fungsi gelombang: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B Dalam kes ini, orbital dicirikan oleh bentuknya yang simetri berkenaan dengan pusat molekul, dan cas elektriknya diagihkan secara simetri di dalamnya. Walau bagaimanapun, contoh lain ialah molekul heteronuklear, di mana hampir mustahil untuk mengekalkan pekali yang sama, serta simetri penuh berkenaan dengan pusat molekul. Apabila tahap tenaga orbital atom Ψ B adalah lebih rendah daripada tahap tenaga orbital atom Ψ A , hubungan itu berlaku, dan maksimum ketumpatan kebarangkalian elektron dialihkan ke arah atom B. Dalam amalan, ini mengakibatkan pergeseran elektron. pasangan dalam ikatan kimia, iaitu polarisasi ke arah atom B. Contohnya, dalam molekul litium hidrida LiH anjakan ini ke arah atom hidrogen, manakala dalam molekul hidrogen fluorida HF ia menuju ke atom fluorin. Ini bermakna bahawa atom hidrogen mempunyai tahap tenaga yang lebih rendah daripada litium, tetapi tahap tenaga yang lebih tinggi daripada fluorin (baca tentang halogen ). Di bawah keadaan ini, salah satu daripada atom kedua-dua molekul mengambil cas negatif yang dilambangkan sebagai -δ dan yang lain adalah positif +δ. Formula am molekul sedemikian ialah A +δ B -δ .
Caj atom
Caj δ yang disebutkan di atas boleh mengambil nilai yang berbeza bergantung pada unsur yang terikat oleh ikatan kimia . Nilainya 0 bermakna bahawa cas pasangan elektron diedarkan secara simetri dan pasangan itu terletak sepenuhnya di sekitar atom dengan tahap tenaga yang lebih rendah, mengakibatkan pemindahan kedua-dua elektron ke atom itu. Ini mewujudkan ikatan ionik antara unsur-unsur. Walau bagaimanapun, dalam sebahagian besar ikatan kimia, terdapat caj pecahan, menghasilkan keadaan antara ikatan kovalen dan ion.
Momen dipol
Dipol ialah molekul di mana dua kutub – positif dan negatif – boleh dibezakan. Momen dipol, dilambangkan dengan μ, ialah ukuran magnitud anjakan cas elektrik di dalamnya. Ia ditakrifkan sebagai hasil darab nilai mutlak cas elektrik (δ) yang terkandung dalam salah satu kutub dan jarak dari kutub ini (l): μ = δ · l Satu cas positif (δ+) dan cas negatif ( δ-) dipanggil caj separa dan lokasinya dikaitkan dengan atom tertentu, tetapi pada hakikatnya ia hanya kebarangkalian yang lebih besar atau lebih kecil bagi elektron yang hadir di sekeliling nukleusnya. Fenomena sedemikian kadangkala dikelirukan dengan proses pengoksidaan dan pengurangan , tetapi tidak seperti perubahan yang berlaku di dalamnya, caj sedemikian yang diambil oleh atom tidak menyebabkan mereka berpindah ke keadaan pengoksidaan yang lain, jadi tidak ada pertukaran elektron antara mereka. Unit SI untuk menyatakan momen dipol ialah meter coulomb (C·m). Walau bagaimanapun, dalam pengiraan unit yang ditulis dalam sistem CGS, debye (D), paling kerap digunakan. Satu debye sepadan dengan nilai 3.33564·10 -30 C·m. Momen dipol terbesar secara teori mungkin mencirikan molekul dengan ikatan ionik semata-mata. Manakala, yang terkecil berlaku dalam molekul yang ikatannya kovalen semata-mata – momen dipol adalah sifar dalam kes ini. Walau bagaimanapun, kebanyakannya adalah kes perantaraan dengan aksara zarah yang berbeza-beza.
Momen dipol halogen
Beberapa hubungan antara keelektronegatifan dan momen dipol boleh diperhatikan dengan mudah pada sebatian kimia tertentu. Jadual 1 Momen dipol hidrogen halida
| Kompaun | Momen dipol yang ditentukan secara eksperimen [ μ, D] | Panjang bon [pm] | Hasil darab cas unsur dan panjang dipol [e ·l, D] | Bahagian aksara ionik [ %] | Perbezaan dalam keelektronegatifan halogen dan hidrogen |
| HF | 1.98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0.9 |
| HBr | 0.79 | 143 | 6.87 | 12 | 0.7 |
| HI | 0.38 | 162 | 7.78 | 5 | 0.4 |
Nisbah μ/(e·l’), iaitu momen dipol sebenar kepada momen dipol yang sepadan dengan ikatan ionik, boleh memberikan ukuran sisihan daripada ikatan kovalen penuh. Hasil darab perhubungan ini dalam bentuk (μ/(e·l’))·100%mewakili peratusan watak ionik dalam ikatan. Ini hanya nilai anggaran, kerana momen dipol bergantung bukan sahaja pada kekutuban ikatan, tetapi juga pada kelakuan pasangan elektron bebas. Ia berlaku bahawa awan elektron boleh dialihkan ke luar molekul, akibatnya ialah persamaan untuk menentukan momen dipolnya mempunyai komponen tambahan. Dalam kes molekul ammonia, awan diarahkan sejajar dengan momen dipol ikatan, mengakibatkan peningkatan momen dipol yang terhasil. Sebaliknya, sebaliknya berlaku untuk molekul karbon monoksida, di mana awan diarahkan ke arah yang bertentangan dan seterusnya mengurangkan momen dipol yang terhasil. 
Keelektronegatifan
Ia adalah kuantiti empirikal tanpa dimensi yang mencerminkan kecenderungan atom tertentu dalam molekul untuk menarik elektron ke arah dirinya sendiri. Dalam amalan, ia adalah keupayaan atom atau kumpulan berfungsi untuk menarik ketumpatan elektron. Skala yang paling biasa digunakan yang dikaitkan dengan kuantiti ini ialah skala yang diperkenalkan oleh Linus Pauling, yang memungkinkan untuk mengira sifat anggaran bon dengan mudah. Ahli sains menggunakan kaedah berikut untuk mengira keelektronegatifan unsur-unsur individu: Kami menganggap bahawa D AA dan D BB ialah tenaga ikatan bagi molekul dua atom (A 2 , B 2 ). Kami menetapkan tenaga pengikat yang berlaku dalam molekul sebagai D AB . Secara empirik, telah ditunjukkan bahawa jika ikatan sedemikian mengandungi sedikit atau tiada watak ionik, perbezaan antara nilai D AB dan min geometri bagi nilai tenaga D AA dan D BB adalah sama atau hampir dengan sifar. Apabila ikatan AB mempunyai sisihan yang jelas daripada watak kovalen, perbezaan ini mengambil nilai positif, yang meningkat apabila perkadaran watak ionik meningkat. Perbezaan antara keelektronegatifan (x) dua atom yang terlibat dalam ikatan dinyatakan dengan formula: ![]() Oleh itu, jika Pauling menganggap keelektronegatifan fluorin sebanyak 4.0 dalam pengiraannya, adalah mungkin untuk mengira keelektronegatifan seterusnya unsur-unsur. Jika kita mengetahui nilai x A bagi atom unsur A dan nilai pekali Δ’ maka kita boleh mengira nilai x B menggunakan persamaan di atas. Skala Pauling dibina sedemikian rupa sehingga nilainya hampir sama dengan nilai momen dipol ikatan yang dibentuk oleh atom yang sedang dipertimbangkan, seperti yang dapat kita lihat daripada contoh dalam Jadual 1, yang mengandungi nilai yang ditentukan untuk hidrogen halida. . Sebagai tambahan kepada skala yang diterangkan di atas, terdapat beberapa lagi yang diterangkan dalam kesusasteraan saintifik, termasuk keelektronegatifan yang diterangkan oleh:
Oleh itu, jika Pauling menganggap keelektronegatifan fluorin sebanyak 4.0 dalam pengiraannya, adalah mungkin untuk mengira keelektronegatifan seterusnya unsur-unsur. Jika kita mengetahui nilai x A bagi atom unsur A dan nilai pekali Δ’ maka kita boleh mengira nilai x B menggunakan persamaan di atas. Skala Pauling dibina sedemikian rupa sehingga nilainya hampir sama dengan nilai momen dipol ikatan yang dibentuk oleh atom yang sedang dipertimbangkan, seperti yang dapat kita lihat daripada contoh dalam Jadual 1, yang mengandungi nilai yang ditentukan untuk hidrogen halida. . Sebagai tambahan kepada skala yang diterangkan di atas, terdapat beberapa lagi yang diterangkan dalam kesusasteraan saintifik, termasuk keelektronegatifan yang diterangkan oleh:
- Mulliken, yang kerjanya mengandaikan bahawa keelektronegatifan unsur adalah berkadar terus dengan jumlah pertalian elektronnya dan tenaga pengionan. Afiniti elektron, iaitu jumlah tenaga yang dibebaskan akibat perlekatan elektron pada atom neutral, dan tenaga pengionan sama dengan jumlah tenaga yang diperlukan untuk melepaskan elektron daripada atom neutral. Oleh itu, keelektronegatifan tertinggi adalah ciri untuk atom yang menunjukkan pertalian elektron tinggi dan tenaga pengionan tinggi.
- Allred dan Rochow, yang menganggap perkadaran keelektronegatifan kepada ukuran daya yang nukleus atom (Z) bertindak ke atas elektron valens, direkodkan sebagai
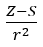 (r – jejari atom, S – pemalar saringan). Menurut teori mereka, keelektronegatifan (x) unsur boleh dikira menggunakan formula:
(r – jejari atom, S – pemalar saringan). Menurut teori mereka, keelektronegatifan (x) unsur boleh dikira menggunakan formula:
![]() Pada setiap skala, keelektronegatifan hidrogen adalah hampir kepada nilai 2.2, dengan nilai lain sedikit berbeza. Contoh keelektronegatifan atom unsur yang dikira mengikut skala Pauling, Mulliken dan Allred dan Rochow ditunjukkan dalam Jadual 2 di bawah. Jadual 2 Keelektronegatifan unsur contoh pada skala Pauling (P), Mulliken (M) dan Allred dan Rochow (AR)
Pada setiap skala, keelektronegatifan hidrogen adalah hampir kepada nilai 2.2, dengan nilai lain sedikit berbeza. Contoh keelektronegatifan atom unsur yang dikira mengikut skala Pauling, Mulliken dan Allred dan Rochow ditunjukkan dalam Jadual 2 di bawah. Jadual 2 Keelektronegatifan unsur contoh pada skala Pauling (P), Mulliken (M) dan Allred dan Rochow (AR)
| Atom | P | M | AR |
| F | 3.98 | 3.90 | 4.10 |
| O | 3.44 | 3.04 | 3.50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2.95 | 2.83 |
| C | 2.55 | 1.75 | 2.50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1.90 | 2.25 | 1.74 |
| F | 0.82 | 0.77 | 0.91 |
| Rb | 0.82 | 0.50 | 0.89 |
| Cs | 0.79 | – | 0.86 |
| Fr | 0.70 | – | 0.86 |
Walaupun terdapat percanggahan dalam pengiraan dengan tiga kaedah, fluorin mempunyai elektronegativiti tertinggi pada setiap skala, diikuti oleh oksigen, nitrogen dan klorin . Nilai terendah ditentukan untuk fransium, caesium, rubidium dan kalium. Unsur-unsur yang lazimnya bukan logam mempunyai keelektronegatifan melebihi nilai 2, logam tipikal mempunyai keelektronegatifan di bawah 2. Nilai piawai ialah keelektronegatifan hidrogen yang disebut di atas kira-kira 2.2. 
Keelektronegatifan dalam jadual berkala
Seperti banyak sifat lain, keelektronegatifan juga dicerminkan dalam susunan unsur kimia pada jadual berkala . Dalam kumpulan, keelektronegatifan berkurangan dengan bertambahnya bilangan cangkang dan watak logam, jadi ia meningkat dalam arah dari fransium kepada hidrogen. Dari masa ke masa, keelektronegatifan meningkat dengan peningkatan dalam elektron valens yang ada dan penurunan dalam watak bukan logam, jadi daripada logam kepada gas mulia .
Keelektronegatifan dan jenis ikatan – ringkasan
Dengan mengetahui nilai individu keelektronegatifan unsur-unsur yang membentuk ikatan kimia, kita boleh menyimpulkan sifatnya. Jika perbezaannya adalah antara 0.0 dan 0.4, ikatan tersebut adalah kovalen. Apabila perbezaan adalah antara 0.4 dan 1.7, ikatan itu adalah kovalen terkutub. Perbezaan di atas 1.7 dalam keelektronegatifan unsur-unsur menunjukkan ikatan ionik.
