Campuran homogen sekurang-kurangnya dua bahan dianggap sebagai penyelesaian. Walaupun kita menganggap penyelesaian terutamanya sebagai cecair, campuran gas dan pepejal juga merupakan penyelesaian. Walau bagaimanapun, kumpulan tindak balas kimia yang sangat besar, baik pada skala makmal dan industri, berlaku dalam persekitaran akueus. Terdapat tiga jenis larutan cecair - pelarut sentiasa cair, tetapi zat terlarut boleh menjadi gas, cecair atau pepejal. Antara contoh ialah larutan akueus hidrogen klorida, etanol dan garam dapur.

Menerangkan komposisi larutan
Ciri paling penting bagi mana-mana penyelesaian ialah definisi komposisinya. Keupayaan untuk menentukan komposisi penyelesaian dan mengira semula bergantung kepada unit minat adalah kemahiran asas setiap ahli kimia. Jumlah bahan tertentu dalam campuran boleh ditakrifkan dalam pelbagai cara, contohnya mengikut jisim, isipadu atau kemolaran. Atas sebab ini, terdapat juga beberapa jenis kepekatan, mentakrifkan pergantungan jumlah komponen pada jumlah larutan atau campuran. Selalunya, apabila menerangkan komposisi penyelesaian, kami menggunakan istilah: pecahan jisim, pecahan isipadu, pecahan mol dan kepekatan molar. Pecahan menunjukkan bahagian campuran tertentu yang diambil kira oleh bahan yang diminati. Ia boleh dinyatakan dalam unit jisim, isipadu atau mol sebatian.
Kepekatan molar
Ini adalah kepekatan yang paling kerap dipilih, kerana kemudahan penggunaan dengan menentukan bilangan mol bahan yang terkandung dalam isipadu larutan. Asas teori ialah pernyataan bahawa larutan dua bahan berbeza dengan kepekatan dan isipadu yang sama, pada suhu yang sama, mengandungi bilangan mol yang sama, dan oleh itu bilangan molekul zat terlarut yang sama. Berdasarkan hubungan ini, untuk larutan dengan kepekatan molar yang sama adalah mungkin untuk mencampurkan isipadu larutan yang sesuai untuk mencapai perkadaran yang betul bagi bilangan mol yang ditentukan oleh pekali stoikiometri. Ini bermakna, jika memikirkan tindak balas jenis A + B → C, di mana satu mol bahan A bertindak balas dengan satu mol bahan B, isipadu yang sama bagi kedua-dua larutan dengan kepekatan molar yang sama mesti dicampur agar tindak balas itu diteruskan sepenuhnya. Dalam kes tindak balas jenis A + 2B → C, iaitu satu mol bahan A bertindak balas dengan dua mol bahan B, satu isipadu larutan A hendaklah dicampurkan dengan dua isipadu larutan B. Dalam kes ini, terdapat juga larutan lain, kerana daripada menggunakan larutan ekuimolar dalam nisbah isipadu 1:2, seseorang boleh menggunakan satu isipadu larutan A dan satu isipadu larutan B dua kali ganda kepekatan. Kepekatan molar, dilambangkan dengan C m , mentakrifkan bilangan mol bahan yang terkandung dalam unit isipadu, selalunya dalam 1 dm 3 , larutan. Formula yang membolehkan pengiraan kepekatan molar ialah hasil bagi bilangan mol bahan (n s ) dan jumlah isipadu larutan (V sol ) dalam dm 3 : 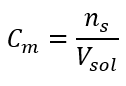 Menggunakan unit isipadu asas mengikut sistem SI, iaitu meter padu, kilomol hendaklah digunakan sebagai unit jumlah bahan. Walau bagaimanapun, ini bukan masalah pengiraan utama, kerana
Menggunakan unit isipadu asas mengikut sistem SI, iaitu meter padu, kilomol hendaklah digunakan sebagai unit jumlah bahan. Walau bagaimanapun, ini bukan masalah pengiraan utama, kerana 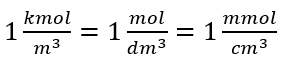 . Unit kepekatan molar C m ditakrifkan sebagai mol per desimeter padu, selalunya dinyatakan sebagai M. 1 mol/dm 3 = 1M
. Unit kepekatan molar C m ditakrifkan sebagai mol per desimeter padu, selalunya dinyatakan sebagai M. 1 mol/dm 3 = 1M 
Penggunaan kepekatan molar
a) Pengiraan kepekatan molar berdasarkan kandungan komponen dalam larutan Contoh 1. Larutan mengandungi 30 g kalium hidroksida dalam 3.0 dm 3 larutan. Kira kepekatan molarnya. Langkah 1. Pengiraan jisim molar KOH 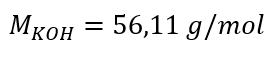 Langkah 2. Pengiraan bilangan mol KOH dalam larutan
Langkah 2. Pengiraan bilangan mol KOH dalam larutan 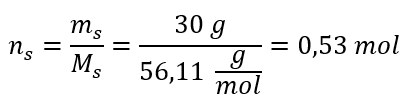 Langkah 3. Pengiraan kepekatan molar menggunakan formula
Langkah 3. Pengiraan kepekatan molar menggunakan formula 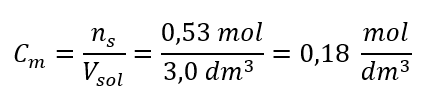 Jawapan: Kepekatan molar larutan kalium hidroksida yang mengandungi 30 g bahan dalam 3.0 dm 3 larutan ialah C m =
Jawapan: Kepekatan molar larutan kalium hidroksida yang mengandungi 30 g bahan dalam 3.0 dm 3 larutan ialah C m = 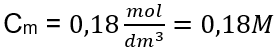 b) Penyediaan larutan dengan kepekatan tertentu Contoh 2. Hitung jisim glukosa (C 6 H 12 O 6 ) yang diperlukan untuk penyediaan 300 cm 3 larutan dengan kepekatan 0.32 mol/dm 3 . Langkah 1. Pengiraan jisim molar glukosa
b) Penyediaan larutan dengan kepekatan tertentu Contoh 2. Hitung jisim glukosa (C 6 H 12 O 6 ) yang diperlukan untuk penyediaan 300 cm 3 larutan dengan kepekatan 0.32 mol/dm 3 . Langkah 1. Pengiraan jisim molar glukosa 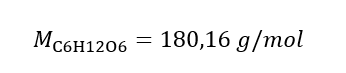 Langkah 2. Pengiraan jisim glukosa yang diperlukan, menggunakan formula molar yang ditukar, mengetahui itu
Langkah 2. Pengiraan jisim glukosa yang diperlukan, menggunakan formula molar yang ditukar, mengetahui itu 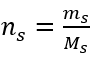 :
: 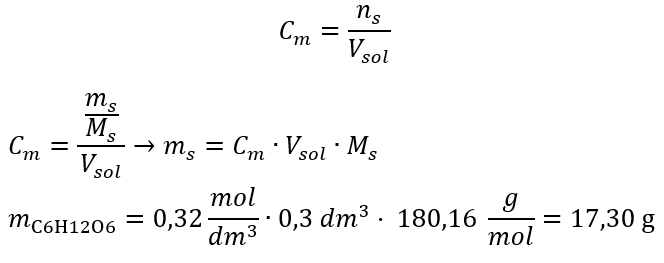 Selepas pengiraan ini, kita tahu bahawa untuk menyediakan penyelesaian sedemikian, 17.30 g glukosa hendaklah ditimbang dan dipindahkan secara kuantitatif ke dalam kelalang volumetrik 300 cm 3 . Jawapan: Untuk menyediakan 300 cm 3 larutan glukosa dengan kepekatan molar 0.32 mol/dm 3 , 17.30 g bahan itu hendaklah ditimbang. c) Pencairan dan kepekatan larutan pekat Menggunakan kepekatan molar, kita juga boleh menyediakan larutan kepekatan tertentu (C m2 ) dengan mencairkan larutan pekat (C m1 ), di mana:
Selepas pengiraan ini, kita tahu bahawa untuk menyediakan penyelesaian sedemikian, 17.30 g glukosa hendaklah ditimbang dan dipindahkan secara kuantitatif ke dalam kelalang volumetrik 300 cm 3 . Jawapan: Untuk menyediakan 300 cm 3 larutan glukosa dengan kepekatan molar 0.32 mol/dm 3 , 17.30 g bahan itu hendaklah ditimbang. c) Pencairan dan kepekatan larutan pekat Menggunakan kepekatan molar, kita juga boleh menyediakan larutan kepekatan tertentu (C m2 ) dengan mencairkan larutan pekat (C m1 ), di mana: 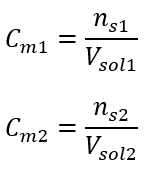 Semasa pencairan, hanya isipadu larutan berubah, bilangan mol zat terlarut kekal tidak berubah. Jadi seseorang boleh menganggap bahawa:
Semasa pencairan, hanya isipadu larutan berubah, bilangan mol zat terlarut kekal tidak berubah. Jadi seseorang boleh menganggap bahawa: ![]() Dengan mengubah formula kepekatan molar, kita memperoleh hubungan berikut:
Dengan mengubah formula kepekatan molar, kita memperoleh hubungan berikut: 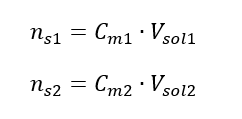 Mengetahui bahawa kita mendapat persamaan:
Mengetahui bahawa kita mendapat persamaan: 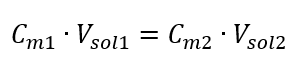 Formula untuk pencairan larutan, dengan pertimbangan kepekatan molar, termasuk yang baru diperolehi (C mx ) boleh dinyatakan sebagai:
Formula untuk pencairan larutan, dengan pertimbangan kepekatan molar, termasuk yang baru diperolehi (C mx ) boleh dinyatakan sebagai:  Contoh 3. Apakah isipadu 0.150 mol/dm 3 asid yang boleh diperolehi dengan mencairkan 250 cm 3 larutan 0.750 mol/dm 3 asid ini dengan air? Langkah 1. Penjelmaan formula dengan andaian bahawa kepekatan air ialah C m2 = 0 mol/dm 3 .
Contoh 3. Apakah isipadu 0.150 mol/dm 3 asid yang boleh diperolehi dengan mencairkan 250 cm 3 larutan 0.750 mol/dm 3 asid ini dengan air? Langkah 1. Penjelmaan formula dengan andaian bahawa kepekatan air ialah C m2 = 0 mol/dm 3 .  Langkah 2. Jumlah pengiraan isipadu (V x )
Langkah 2. Jumlah pengiraan isipadu (V x )  Sebagai alternatif, hubungan kekekalan bilangan tahi lalat semasa pencairan boleh digunakan:
Sebagai alternatif, hubungan kekekalan bilangan tahi lalat semasa pencairan boleh digunakan:  Jawapan: Untuk mencairkan asid kepada kepekatan yang diperlukan, 1.25 dm 3 air mesti digunakan. Contoh 4. Kira berapa banyak air mesti disejat daripada 300 cm 3 larutan dengan kepekatan 0.125 mol/dm 3 untuk mendapatkan larutan dengan kepekatan 1.50 mol/dm 3 . Langkah 1. Penjelmaan formula bagi perubahan kepekatan molar dengan andaian bahawa kepekatan molar air ialah C m2 = 0 mol/dm 3 .
Jawapan: Untuk mencairkan asid kepada kepekatan yang diperlukan, 1.25 dm 3 air mesti digunakan. Contoh 4. Kira berapa banyak air mesti disejat daripada 300 cm 3 larutan dengan kepekatan 0.125 mol/dm 3 untuk mendapatkan larutan dengan kepekatan 1.50 mol/dm 3 . Langkah 1. Penjelmaan formula bagi perubahan kepekatan molar dengan andaian bahawa kepekatan molar air ialah C m2 = 0 mol/dm 3 . 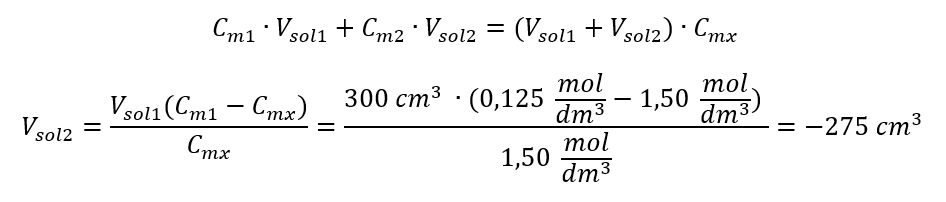 Jawapan: Untuk menumpukan larutan, 275 mesti disejat. Penukaran kepekatan molar vs kepekatan peratusan Dalam kerja makmal harian, adalah perlu untuk menukar kepekatan larutan yang berbeza. Selalunya, kepekatan molar dan peratusan kepekatan digunakan. Ia adalah mungkin untuk menukar antara mereka menggunakan ketumpatan penyelesaian. Parameter ini mesti diperkenalkan kepada formula untuk kepekatan minat:
Jawapan: Untuk menumpukan larutan, 275 mesti disejat. Penukaran kepekatan molar vs kepekatan peratusan Dalam kerja makmal harian, adalah perlu untuk menukar kepekatan larutan yang berbeza. Selalunya, kepekatan molar dan peratusan kepekatan digunakan. Ia adalah mungkin untuk menukar antara mereka menggunakan ketumpatan penyelesaian. Parameter ini mesti diperkenalkan kepada formula untuk kepekatan minat: 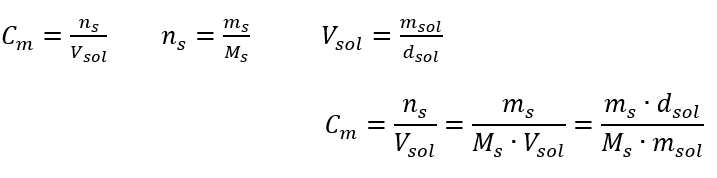 Dalam penjelmaan, kita dapat melihat nisbah jisim bahan kepada jisim larutan, yang merupakan asas kepekatan peratusan, dinyatakan oleh formula:
Dalam penjelmaan, kita dapat melihat nisbah jisim bahan kepada jisim larutan, yang merupakan asas kepekatan peratusan, dinyatakan oleh formula: 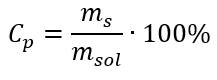 Menggantikan formula untuk peratusan kepekatan ke dalam formula yang telah diubah sebelumnya untuk kepekatan molar, kita mendapat hubungan yang membolehkan kita menukar secara bebas antara dua nilai:
Menggantikan formula untuk peratusan kepekatan ke dalam formula yang telah diubah sebelumnya untuk kepekatan molar, kita mendapat hubungan yang membolehkan kita menukar secara bebas antara dua nilai: 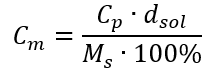 Satu-satunya had formula ialah penggunaan unit yang sesuai, jadi ia patut dipertimbangkan dalam semua pengiraan. Contoh 5. Kira kepekatan molar asid sulfurik (VI) dengan mengetahui peratusan kepekatannya ialah C p = 98.0 %dan ketumpatannya ialah d = 1.84 kg/dm 3 . Ini boleh dikira menggunakan dua kaedah: Kaedah 1. Dalam beberapa langkah, tanpa menggunakan formula Langkah 1. Pengiraan jisim 1.00 dm 3 asid
Satu-satunya had formula ialah penggunaan unit yang sesuai, jadi ia patut dipertimbangkan dalam semua pengiraan. Contoh 5. Kira kepekatan molar asid sulfurik (VI) dengan mengetahui peratusan kepekatannya ialah C p = 98.0 %dan ketumpatannya ialah d = 1.84 kg/dm 3 . Ini boleh dikira menggunakan dua kaedah: Kaedah 1. Dalam beberapa langkah, tanpa menggunakan formula Langkah 1. Pengiraan jisim 1.00 dm 3 asid 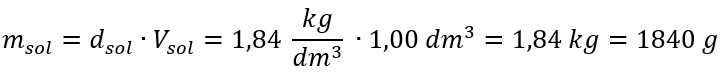 Langkah 2. Pengiraan jisim asid dengan mengambil kira peratusan kepekatan
Langkah 2. Pengiraan jisim asid dengan mengambil kira peratusan kepekatan 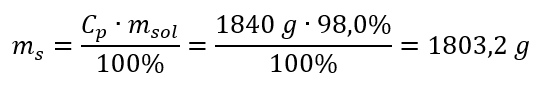 Langkah 3. Pengiraan bilangan tahi lalat
Langkah 3. Pengiraan bilangan tahi lalat 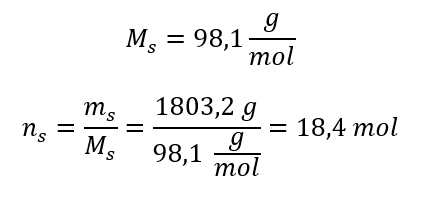 Langkah 4. Pengiraan kepekatan molar mengetahui bahawa ia ialah bilangan mol bahan dalam 1 dm 3 larutan
Langkah 4. Pengiraan kepekatan molar mengetahui bahawa ia ialah bilangan mol bahan dalam 1 dm 3 larutan 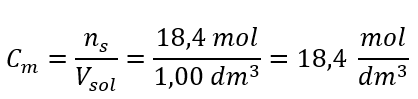 Kaedah 2. Menggunakan hubungan antara peratus kepekatan dan kepekatan molar
Kaedah 2. Menggunakan hubungan antara peratus kepekatan dan kepekatan molar 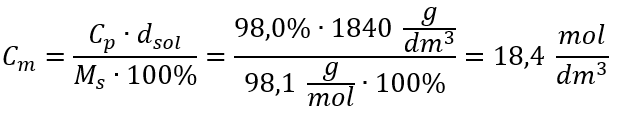 Jawapan: Kepekatan molar asid ini ialah 18.4 mol/dm 3 .
Jawapan: Kepekatan molar asid ini ialah 18.4 mol/dm 3 .
