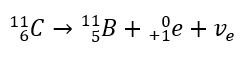Untuk melakukan ujian, filem fotografi digunakan, yang menjadi hitam di bawah pengaruh sinar ini. Eksperimen telah menunjukkan bahawa sinaran suria tidak diperlukan untuk bahan ujian untuk menghitamkan filem. Walau bagaimanapun, ini bercanggah dengan hipotesis awal, jadi kajian lanjut perlu dijalankan. Kali ini, tugasnya adalah untuk mengesahkan atau menafikan sinar-X sebagai faktor yang menyebabkan perubahan dalam filem itu. Fakta bahawa sinar-X tidak membawa apa-apa cas, jadi ia tidak dibengkokkan oleh medan magnet, telah digunakan. Becquerel meletakkan bahan yang mengandungi uranium dan filem fotografi di dalam kebuk vakum yang terletak di medan magnet. Hasil daripada eksperimen itu, didapati bahawa sinaran yang dipancarkan oleh sampel yang diuji membengkok dalam medan magnet, yang bermaksud ia tidak sama dengan sinar-X. Semasa meneruskan penyelidikannya, saintis menunjukkan bahawa terdapat tiga jenis sinaran yang boleh dipancarkan oleh bahan – neutral, bercas positif dan bercas negatif. Berdasarkan andaian ini, penyelidik seterusnya mengemukakan tesis mereka dan menjalankan eksperimen selanjutnya. Maria Skłodowska Curie dan Pierre Curie menemui unsur radioaktif seterusnya: polonium dan radium. Ernest Rutherford, pemenang Hadiah Nobel dalam bidang kimia , juga menumpukan sebahagian daripada kerjayanya kepada radioaktiviti dan menamakan jenis sinaran yang ditemui oleh Becquerel dengan huruf Yunani abjad: alfa, beta dan gamma.
Dari mana datangnya radioaktiviti?
Penyelidikan telah menunjukkan bahawa radioaktiviti adalah ciri beberapa unsur. Ini menunjukkan hubungan rapatnya dengan tahap atom mereka, dan lebih khusus – dengan nukleus atom. Setiap satu daripada tiga jenis sinaran adalah kuantum tenaga yang boleh dipancarkan oleh nukleus yang tidak stabil. Ini bermakna sinaran itu sebenarnya adalah hasil daripada pereputan mereka. Kejadian nukleus yang tidak stabil ini dalam amalan disebabkan oleh nisbah proton kepada neutron. Disebabkan oleh pelbagai jenis ketidakstabilan, terdapat juga jenis radiasi yang berbeza. Kunci untuk memahami radioaktiviti adalah isotop dan perbezaannya pada peringkat atom. Sebagai contoh, isotop karbon yang paling biasa 12 C bukan radioaktif, manakala 14 C adalah radioaktif. Nombor atom mereka, dan oleh itu bilangan proton, adalah sama. Perbezaan juga tidak boleh disebabkan oleh bilangan elektron, kerana atom kemudiannya akan menjadi ion bercas positif atau negatif. Satu-satunya kemungkinan, dalam kes isotop, adalah perbezaan dalam bilangan neutron dalam nukleus. 14 C mempunyai dua neutron lebih daripada 12 C, jadi ia juga lebih berat. Kewujudan isotop untuk semua unsur bermakna bilangan nukleus radioaktif juga besar. Isotop yang tidak stabil dan radioaktif sedemikian dipanggil radioisotop, tetapi kelazimannya tidak setinggi yang boleh dilihat dalam jadual unsur berkala .
Mengapa nukleus boleh tidak stabil?
Proton dan neutron dalam nukleus tertakluk kepada daya nuklear besar yang menahan mereka bersama-sama, mengatasi tolakan elektrostatik antara proton. Tidak seperti proton, neutron mempunyai kesan positif terhadap pengukuhan daya nuklear. Telah ditunjukkan bahawa nisbah bilangan neutron kepada proton hendaklah kira-kira 1.5:1. Untuk atom yang lebih ringan di bawah 20u, nisbah stabil ialah 1:1. Jika tidak, nukleus cenderung hancur. Semua isotop unsur dengan berat atom melebihi 208 adalah tidak stabil.
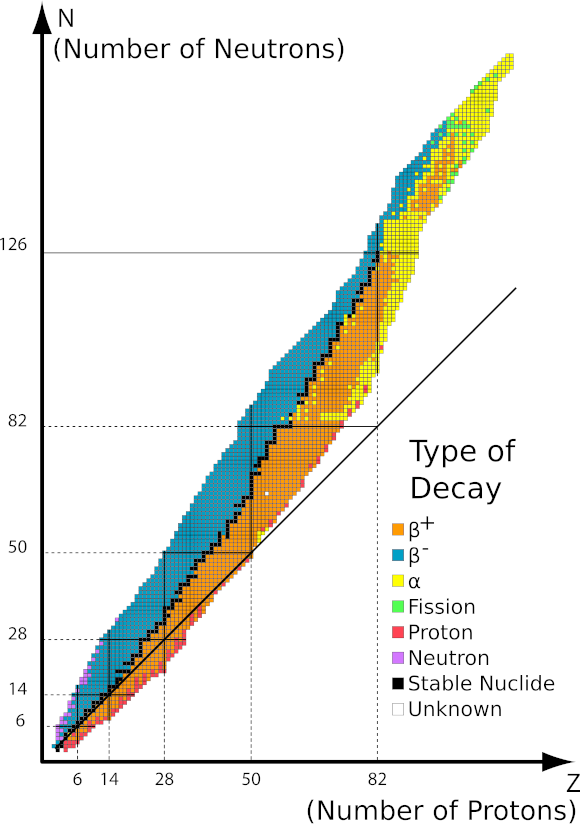
Gambar 1 Graf kawasan kestabilan bergantung kepada bilangan nukleon dalam nukleus. Sumber: http://ch302.cm.utexas.edu/nuclear/radioactivity/selector.php?name=band-stability
Graf yang dibentangkan di atas menunjukkan pergantungan kestabilan nukleus pada bilangan nukleon individu. Garis hitam sepadan dengan nisbah 1:1 neutron kepada proton. Isotop stabil ditandakan dengan segi empat sama hitam dan isotop tidak stabil dengan warna yang sepadan mengikut legenda. Kestabilan isotop radioaktif adalah lebih besar semakin hampir kepada nisbah yang stabil. Menurut graf, kita boleh membezakan tiga jenis pereputan:
- Pereputan alfa, terutamanya dalam nukleus besar, memancarkan dua proton dan dua neutron,
- Pereputan beta tolak, apabila nukleus mempunyai terlalu sedikit proton, mengakibatkan pelepasan elektron,
- Pereputan beta tambah, jika nukleus atom mempunyai lebihan proton, dengan pelepasan positron.
Jenis pereputan ini melibatkan perubahan dalam bilangan proton dalam nukleus, dan oleh itu juga perubahan unsur kimia dari satu kepada yang lain.
Sinaran alfa (α).
Secara eksperimen, pada tahun 1909 E. Rutherford dan T. Royds menunjukkan bahawa zarah alfa adalah sama dengan ion helium. Selepas melepasi sinaran alfa melalui dinding nipis ruang vakum, imej garis spektrum pada spektrometer optik yang diperolehi dalam ruang gas dengan jelas mengesahkan ini. Sebagai contoh, nukleus 240 Pu menjalani sinaran alfa, mengikut tindak balas: 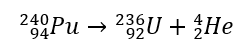 Sinaran alfa dicirikan oleh zarah bercas positif dengan julat beberapa sentimeter di udara dan kebolehtelapan yang sangat rendah. Sehelai kertas akan menghalang mereka.
Sinaran alfa dicirikan oleh zarah bercas positif dengan julat beberapa sentimeter di udara dan kebolehtelapan yang sangat rendah. Sehelai kertas akan menghalang mereka.
Sinaran beta (β).
Dalam kes sinaran beta-tolak, elektron yang datang dari nukleus dipancarkan. Oleh kerana nukleus tidak dicirikan oleh kehadiran elektron, ia hanya terbentuk semasa pereputan, dan sebagai tambahan kepada mereka, zarah kedua juga dipancarkan – elektron anti-neutrino. Disebabkan oleh peningkatan bilangan proton dalam molekul, unsur pereputan beta berubah menjadi unsur lain dengan nombor atom yang lebih tinggi. Contoh kursus pereputan adalah konsisten dengan mekanisme ini: 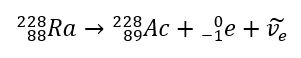 Sinaran ini dicirikan oleh zarah bercas negatif dengan julat beberapa dozen sentimeter di udara dan kebolehtelapan yang lebih besar berbanding sinaran alfa. Ia dihentikan oleh kepingan aluminium dengan ketebalan kira-kira 3 hingga 4 mm. Pereputan beta-plus berlaku sama, tetapi ia mengeluarkan zarah positron dan neutrino elektron. Bilangan proton dalam nukleus berkurangan dan unsur yang mengalaminya diubah menjadi satu lagi dengan nombor atom yang lebih rendah, seperti dalam contoh:
Sinaran ini dicirikan oleh zarah bercas negatif dengan julat beberapa dozen sentimeter di udara dan kebolehtelapan yang lebih besar berbanding sinaran alfa. Ia dihentikan oleh kepingan aluminium dengan ketebalan kira-kira 3 hingga 4 mm. Pereputan beta-plus berlaku sama, tetapi ia mengeluarkan zarah positron dan neutrino elektron. Bilangan proton dalam nukleus berkurangan dan unsur yang mengalaminya diubah menjadi satu lagi dengan nombor atom yang lebih rendah, seperti dalam contoh: 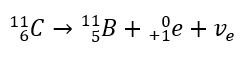
Sinaran gamma (γ).
Ia adalah satu-satunya jenis sinaran yang tidak mengubah unsur menjadi unsur lain, kerana ia tidak mengeluarkan sebarang zarah, hanya sinaran gamma itu sendiri. Ia adalah salah satu jenis gelombang elektromagnet, sama seperti cahaya infra-merah atau ultraviolet, tetapi gelombang sinaran gamma adalah yang paling pendek. Proses pereputan menyebabkan peralihan nukleus atom yang teruja kepada keadaan tenaga yang lebih rendah, mengakibatkan pancaran foton dengan tenaga yang setara dengan nukleus atom dalam keadaan individu. Gambar rajah perjalanan pereputan gamma boleh ditulis sebagai: 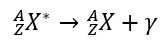 Ciri sinaran gamma adalah pengenalannya dengan gelombang elektromagnet frekuensi tinggi dan sifat seperti cahaya. Julat dalam udara secara teorinya tidak terhad, manakala kebolehtelapan adalah yang terbesar dari semua jenis radioaktiviti. Ia dihentikan hanya oleh dinding tebal atau lapisan plumbum lima belas sentimeter.
Ciri sinaran gamma adalah pengenalannya dengan gelombang elektromagnet frekuensi tinggi dan sifat seperti cahaya. Julat dalam udara secara teorinya tidak terhad, manakala kebolehtelapan adalah yang terbesar dari semua jenis radioaktiviti. Ia dihentikan hanya oleh dinding tebal atau lapisan plumbum lima belas sentimeter.


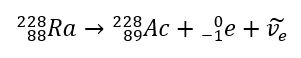 Sinaran ini dicirikan oleh zarah bercas negatif dengan julat beberapa dozen sentimeter di udara dan kebolehtelapan yang lebih besar berbanding sinaran alfa. Ia dihentikan oleh kepingan aluminium dengan ketebalan kira-kira 3 hingga 4 mm. Pereputan beta-plus berlaku sama, tetapi ia mengeluarkan zarah positron dan neutrino elektron. Bilangan proton dalam nukleus berkurangan dan unsur yang mengalaminya diubah menjadi satu lagi dengan nombor atom yang lebih rendah, seperti dalam contoh:
Sinaran ini dicirikan oleh zarah bercas negatif dengan julat beberapa dozen sentimeter di udara dan kebolehtelapan yang lebih besar berbanding sinaran alfa. Ia dihentikan oleh kepingan aluminium dengan ketebalan kira-kira 3 hingga 4 mm. Pereputan beta-plus berlaku sama, tetapi ia mengeluarkan zarah positron dan neutrino elektron. Bilangan proton dalam nukleus berkurangan dan unsur yang mengalaminya diubah menjadi satu lagi dengan nombor atom yang lebih rendah, seperti dalam contoh: