Dalam kes tindak balas kimia, penukaran lengkap substrat kepada produk diperhatikan hanya untuk sebahagian kecil daripadanya. Sebahagian besar, termasuk yang berlaku di dalam badan kita, boleh diterbalikkan. Untuk proses sedemikian, keadaan keseimbangan kimia diwujudkan. Ini adalah konsep yang sangat penting dalam kimia, yang dikaitkan dengan, sebagai contoh, prinsip Le Chatelier (atau Undang-undang Keseimbangan). Pengetahuan tentang undang-undang dan prinsip asas mengenai keseimbangan kimia membolehkan, contohnya, meramalkan banyak tindak balas atau menjalankan proses teknologi dengan lebih cekap.
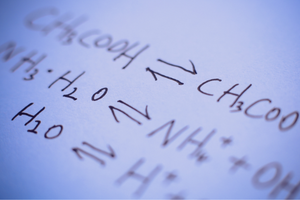
Reaksi boleh balik dan tidak boleh balik
Dengan mengambil kira perjalanan tindak balas kimia, pembahagian umum boleh dibuat – kepada tindak balas boleh balik dan tidak boleh balik. Walau bagaimanapun, harus diingat bahawa pada hakikatnya tidak ada 100%tindak balas yang tidak dapat dipulihkan, dan kelayakan kepada kumpulan tertentu adalah berdasarkan kesan akhir yang berlaku.
Reaksi yang tidak dapat dipulihkan
Dalam kes ini, substrat dalam sistem bertindak balas dan menghasilkan produk tertentu. Walau bagaimanapun, tiada transformasi terbalik – produk menjadi substrat . Dalam formula, anak panah tunggal ditandakan di antara bahan tindak balas, dan anak panah itu menghala ke arah produk. Reaksi yang tidak dapat dipulihkan adalah terutamanya semua tindak balas di mana mendakan terbentuk. Dalam amalan, mereka tidak larut dalam air dan tidak boleh dibentuk semula. Keterbalikan proses juga sukar dicapai dalam kes tindak balas yang berlaku dalam sistem terbuka, iaitu dalam bikar atau kelalang sfera, yang mana salah satu produk yang terhasil, contohnya karbon dioksida, boleh keluar dengan bebas, tetapi dengan mengubah keadaan. daripada tindak balas, iaitu dengan memindahkannya ke sistem tertutup, ia boleh dibuat boleh balik. Kumpulan tindak balas tak boleh balik juga merangkumi semua proses di mana interaksi antara molekul produk berlaku pada tahap yang lebih rendah berbanding antara substrat. Oleh itu, proses sedemikian berlaku dalam kedua-dua arah, tetapi disebabkan oleh fakta bahawa penyusunan semula substrat diabaikan, dalam praktiknya ia diklasifikasikan sebagai tindak balas tidak dapat dipulihkan.
Reaksi boleh balik
Ini adalah tindak balas di mana produk terbentuk daripada substrat dan, pada masa yang sama, proses sebaliknya berlaku dengan keamatan yang setanding – iaitu penyusunan semula substrat daripada produk. Dalam formula tindak balas, dua anak panah diletakkan di antara bahan tindak balas, dengan anak panah menghala ke arah yang bertentangan, untuk menunjukkan kebolehbalikan tindak balas yang berlaku. Tindak balas boleh balik adalah terutamanya yang dijalankan dalam sistem tertutup. Molekul substrat dan produk tidak dapat meninggalkan persekitaran tindak balas dan mereka berlanggar antara satu sama lain, mencipta produk dan menyusun semula substrat. Contoh tindak balas sedemikian ialah penghasilan hidrogen iodida daripada iodin dan hidrogen.
Keadaan keseimbangan kimia
Sama ada tindak balas tertentu boleh berlaku, atau jika ia boleh diterbalikkan atau tidak boleh diterbalikkan, bergantung pada keadaan proses tertentu dan jenis proses. Jika tindak balas boleh balik berlaku, iaitu substrat berubah menjadi produk akibat tindak balas kimia dan, pada masa yang sama, akibat perlanggaran molekul produk, substrat mengalami rekreasi, kemudian pada satu ketika apabila tindak balas ini berlaku, keadaan keseimbangan kimia diwujudkan . Dalam erti kata lain, kepekatan substrat dan produk dalam sistem berada pada tahap yang tetap – jumlahnya tidak berubah walaupun terdapat tindak balas yang berterusan. Dalam keadaan keseimbangan kimia, kadar tindak balas dalam kedua-dua arah adalah sama. Keseimbangan kimia, dalam keadaan tertentu, bermaksud keadaan paling stabil untuk sistem tertentu. Keperluan tenaga kemudiannya sangat rendah. Pemalar keseimbangan kimia, K , ialah pekali yang menerangkan keseimbangan dua tindak balas boleh balik. Ia ditakrifkan sebagai hasil bagi kepekatan produk dan substrat yang dinaikkan kepada kuasa yang sepadan dengan pekali stoikiometri yang diukur dalam keadaan keseimbangan kimia. Formula untuk pemalar telah diperolehi pada tahun 1864 sebagai apa yang dipanggil undang-undang tindakan jisim. Perlu diingat bahawa ini adalah nilai ciri untuk tindak balas tertentu. Beberapa faktor mempengaruhi keadaan keseimbangan kimia. Ini adalah sebahagian daripadanya:
- suhu,
- isipadu sistem tindak balas,
- tekanan,
- kepekatan bahan tindak balas.
Apa yang penting, kedudukan keadaan keseimbangan tidak dipengaruhi oleh penambahan atau perubahan mangkin tindak balas. Tugasnya hanyalah untuk memendekkan masa di mana keseimbangan dicapai. 
Prinsip Le Chatelier (Undang-undang Keseimbangan)
Dengan mengubah keadaan tindak balas tertentu, kita boleh mempengaruhi keseimbangannya. Sistem ini akan sentiasa berusaha untuk mengekalkan keseimbangan, kerana ia sangat menguntungkan untuknya (perbelanjaan tenaga terendah). Akibatnya, akan ada perubahan yang menentang faktor yang menyebabkan sistem tidak seimbang. Fenomena ini dijelaskan pada tahun 1881 dan dikenali hari ini sebagai prinsip Le Chatelier-Braun atau sebagai Undang-undang Keseimbangan. Ia membolehkan untuk memahami tindak balas sistem kepada perubahan dalam keadaan tindak balas, yang berada dalam keadaan keseimbangan kimia. Penambahan salah satu bahan bertindak balas kepada sistem menyebabkan gangguan kepada keseimbangan. Kepekatan bahan tindak balas individu berubah. Oleh itu, untuk mengatasi masalah ini, sistem cenderung untuk menghasilkan lebih banyak produk (apabila substrat telah ditambah) atau untuk membentuk semula substrat (apabila jumlah produk tertentu telah ditambah). Menukar suhu tindak balas mempunyai kesan yang besar, terutamanya untuk proses endotermik dan eksotermik. Dalam kes yang pertama, adalah perlu untuk membekalkan tenaga kepada sistem dalam bentuk haba, jadi meningkatkan suhu keseluruhan proses akan mengalihkan keseimbangan ke kanan (menurun ke kiri), ke arah pembentukan lebih banyak produk . Sebaliknya akan berlaku untuk tindak balas eksotermik, di mana salah satu produk adalah haba. Suhu tidak mempunyai kesan ke atas keseimbangan tindak balas, di mana tiada kesan haba diperhatikan. Dalam kes tindak balas yang berlaku dalam fasa gas, tekanan adalah aspek yang sangat penting. Meningkatkan nilai parameter ini, iaitu mengurangkan isipadu tindak balas sistem, akan menyebabkan keseimbangan tindak balas beralih. Arah perubahan bergantung kepada pekali stoikiometri dalam persamaan tindak balas. Parameter ini tidak akan menjejaskan keseimbangan kimia tindak balas di mana jumlah pekali stoikiometri substrat dan produk gas adalah sama. Perlu diingat bahawa apabila sistem dibuang daripada keseimbangan kimia, Hukum Keseimbangan akan terpakai dan, akibatnya, keadaan keseimbangan baru akan dicapai.
