Dalam kimia, beberapa sebatian kimia membentuk ikatan khas dengan molekul air. Ini bukan ikatan kimia, tetapi interaksi jarak pendek yang secara khusus menentukan sifat sebatian ini. Kita bercakap tentang hidrat. Hartanah mereka mudah digunakan dalam sektor perindustrian terpilih. Garam terhidrat yang paling popular sudah pasti gipsum, atau kalsium sulfat dihidrat (VI), yang merupakan bahan mentah penting dalam industri pembinaan. Hidrat juga merupakan penunjuk kandungan lembapan yang sangat baik. Ini berkaitan dengan fakta bahawa warna garam kontang sering berbeza daripada garam terhidrat.

Menghidrat
Hidrat bukanlah sebatian kimia di mana ikatan kimia , seperti ikatan kovalen , berlaku di antara molekul air dan molekul garam yang diberikan . Mereka juga bukan sebatian koordinasi. Pembentukan ikatan hidrogen, yang jauh lebih lemah dalam kekuatan daripada ikatan kimia, adalah ciri struktur ini. Hidrat distrukturkan dalam bentuk kekisi kristal. Molekul air diagihkan secara tidak teratur di dalamnya. Istilah "air penghabluran" sering digunakan. Hidrat diperoleh melalui penghidratan . Molekul garam, terutamanya derivatif asid tak organik, berkemungkinan besar mengalami tindak balas ini. Penghidratan melibatkan perubahan hablur kontang kepada yang terhidrat. Ia boleh menyebabkan perubahan dalam jisim mineral, tetapi tidak memusnahkannya. Penghidratan selalunya mengiringi proses lain, seperti pengkarbonan. Bahan kimia penghidratan, dalam keadaan biasa, dicirikan oleh higroskopisitas tinggi , iaitu pertalian yang kuat untuk molekul air. Bahan sedemikian mampu, sebagai contoh, menyerap lembapan dari udara . Cara lain untuk mendapatkan hidrat adalah dengan mengkristalkannya daripada larutan akueus. Formula molekul hidrat dibentuk dengan menulis formula garam dan menyatakan bilangan molekul air terhidrat. Untuk memberikan tatatanda umum, huruf ‘n’ diletakkan sebelum ‘H 2 O’. Nilainya lebih besar daripada satu dan ia sepadan dengan bilangan molekul air yang melekat. Perbezaan yang paling biasa ialah antara hidrat dengan n=½ (hemihidrat), n= 1 (monohidrat), n=2 (dihidrat) dan n=3 (trihidrat). Yang penting, bahan yang sama boleh melekatkan bilangan molekul air yang berbeza. ![]()
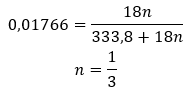 Memandangkan terdapat ikatan hidrogen antara molekul garam dan molekul air, sebatian ini tidak menunjukkan rintangan yang memuaskan terhadap suhu tinggi. Apabila mereka dipanaskan, mereka hancur dan berubah kepada bentuk anhydrous. Hidrat larut dengan baik dalam air. Dalam larutan akueus, molekul air terhidrat yang melekat pada garam dibebaskan. Fakta ini harus diambil kira, sebagai contoh, apabila membuat penyelesaian bahan-bahan ini. Kegagalan untuk mengambil kira tahap penghidratan sebatian tertentu mengakibatkan ralat, jika hanya dalam penentuan kepekatan larutan. Ciri penting garam terhidrat ialah perubahan warnanya disebabkan oleh perlekatan molekul air dalam tindak balas penghidratan. Perlu diingatkan bahawa bentuk terhidrat menunjukkan kurang higroskopisitas berbanding dengan garam kontang.
Memandangkan terdapat ikatan hidrogen antara molekul garam dan molekul air, sebatian ini tidak menunjukkan rintangan yang memuaskan terhadap suhu tinggi. Apabila mereka dipanaskan, mereka hancur dan berubah kepada bentuk anhydrous. Hidrat larut dengan baik dalam air. Dalam larutan akueus, molekul air terhidrat yang melekat pada garam dibebaskan. Fakta ini harus diambil kira, sebagai contoh, apabila membuat penyelesaian bahan-bahan ini. Kegagalan untuk mengambil kira tahap penghidratan sebatian tertentu mengakibatkan ralat, jika hanya dalam penentuan kepekatan larutan. Ciri penting garam terhidrat ialah perubahan warnanya disebabkan oleh perlekatan molekul air dalam tindak balas penghidratan. Perlu diingatkan bahawa bentuk terhidrat menunjukkan kurang higroskopisitas berbanding dengan garam kontang.
Hidrat sebatian tak organik
Garam asid tak organik ialah bahan yang paling berkemungkinan membentuk hidrat dengan molekul air. Hidrat yang paling biasa bagi sebatian tak organik termasuk:
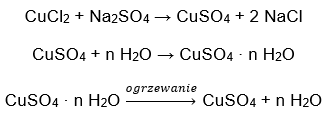
- Kuprum (II) sulfat hidrat (VI), CuSO 4 – kuprum (II) sulfat (VI) menggunakan pelbagai darjah penghidratan. Bilangan maksimum molekul air yang melekat ialah lima. Akibat pemanasan pentahidrat garam ini, molekul air dilucutkan. Dua pertama dan trihidrat terbentuk, dan pada pemanasan selanjutnya sistem, kuprum (II) sulfat monohidrat (VI) boleh diperolehi. Untuk mengeluarkan molekul air terakhir, ia perlu memanaskan sebatian pada suhu lebih daripada 200 ᵒC. Kuprum (II) sulfat hidrat (VI) berwarna biru, yang disebabkan oleh kehadiran air penghabluran di sekeliling ion kuprum. Manakala garam kontang berwarna putih. Higroskopisitasnya yang tinggi dan keupayaan untuk membentuk hidrat digunakan untuk menghilangkan lembapan daripada sesetengah cecair.
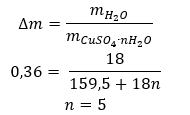
- Kobalt (II) klorida hidrat, CoCl 2 – kobalt kobalt (II) klorida sangat higroskopik. Terima kasih kepada pertalian yang kuat untuk molekul air, ia mampu menyerap lembapan walaupun dari udara. Proses ini mengakibatkan pembentukan hidrat garam ini. Bentuk terhidrat yang paling biasa ialah kobalt (II) klorida heksahidrat – CoCl 2 * 6H 2 Bentuk lain ialah molekul dihidrat. Garam ini juga menunjukkan keupayaan untuk menukar warna bergantung kepada kandungan lembapannya. Garam kontang berwarna biru, dihidrat mengambil warna merah jambu-ungu, dan warna molekul heksahidrat adalah merah pekat.
- Natrium sulfat hidrat (VI), Na 2 SO 4 – garam ini wujud dalam bentuk dua hidrat: heptahidrat (lima molekul air dalam struktur) dan decahydrate (sepuluh molekul air dalam struktur). Bentuk anhydrous natrium sulfat (VI) berlaku di alam semula jadi sebagai mineral thénardite yang jarang ditemui. Sodium sulfat ten-hydrate (VI) ialah garam Glauber yang dipanggil. Ia digunakan secara meluas dalam pengeluaran kaca, kertas, detergen dobi dan soda. Garam Glauber juga merupakan salah satu bahan yang diperlukan untuk penghasilan ultramarine pigmen biru. Di samping itu, sebatian itu mempunyai kesan terapeutik pada sistem pencernaan, kerana sifat julapnya.

Gipsum
Contoh hidrat garam tak organik yang mempunyai kepentingan global dan aplikasi luas ialah gipsum. Ia adalah mineral yang terdiri daripada bentuk terhidrat kalsium sulfat (VI), CaSO 4 . Gipsum kristal adalah dihidrat garam ini. Di bawah keadaan semula jadi, ia terbentuk semasa penyejatan air masin dari tasik dan sungai, pada suhu di bawah 42ᵒC. Kalsium sulfat kontang (VI) ialah anhidrit. Ia juga dirujuk sebagai gipsum anhydrous. Binaan gipsum pula ialah kalsium sulfat hemihidrat (VI). Bentuk garam ini yang manakah diperoleh bergantung pada suhu semasa pemprosesan batuan enapan induk. Gipsum yang digunakan dalam pembinaan biasanya merupakan campuran pelbagai bentuk garam kapur terhidrat. 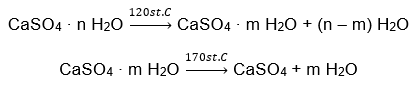
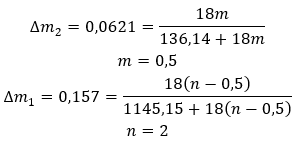 Kemungkinan aplikasi untuk gipsum sangat luas, terutamanya dalam industri pembinaan. Kegunaan paling penting garam hidrat ini disenaraikan di bawah:
Kemungkinan aplikasi untuk gipsum sangat luas, terutamanya dalam industri pembinaan. Kegunaan paling penting garam hidrat ini disenaraikan di bawah:
- Dalam industri pembinaan, gipsum digunakan dalam elemen penamat. Ia adalah salah satu komponen produk separuh siap longgar, mortar, pelekat, kemasan berasaskan gipsum dan komponen pemasangan siap campur, cth papan eternit.
- Ubat menggunakan plaster untuk menahan anggota badan yang patah. Pembalut gipsum dianggap mesra kulit. Selain itu, bahan tersebut juga digunakan dalam makmal teknologi pergigian.
- Industri menggunakan gipsum dalam bengkel pemodelan dan reka bentuk. Tuangan plaster sangat sesuai untuk membentuk pelbagai objek utilitarian.
- Gipsum adalah bahan tambahan kepada beberapa baja yang digunakan dalam pertanian.

Klatrat metana
Klatrat metana tergolong dalam kumpulan sebatian yang dikenali sebagai hidrat gas. Mereka bertanggungjawab terhadap kebanyakan perubahan iklim yang pesat dalam sejarah Bumi. Klatrat metana juga sering dirujuk sebagai hidrat metana atau ais metana. Mereka membentuk bentuk pepejal air dan metana . Molekul mereka dibezakan oleh struktur kristalnya. Mereka terbentuk di bawah tekanan yang meningkat. Mereka mengambil bentuk pepejal putih, tidak berbau, yang selalunya serupa, dari segi rupa luaran, dengan ais. Menariknya, mereka menyerupai polistirena apabila disentuh. Clathrates ialah kumpulan kimia yang unik . Molekul air membentuk struktur yang menyerupai sangkar. Metana disimpan di dalam sangkar ini. Yang penting, kedua-dua bahan itu tidak membentuk ikatan kimia antara satu sama lain. Biasanya, klatrat metana terdiri daripada 46 molekul air yang mengelilingi dua sangkar kecil dan enam bersaiz sederhana. Molekul metana terperangkap di dalamnya. Clathrates juga diketahui terdiri daripada 136 molekul air dengan 16 sangkar kecil dan lapan besar gas metana di dalamnya. Dalam beberapa tahun kebelakangan ini, sejumlah besar sumber ini telah ditemui di dasar lautan. Ia menarik banyak minat kerana potensi untuk mengekstrak kuantiti metana yang besar, yang boleh digunakan, contohnya, untuk tujuan tenaga. Klatrat metana terbakar dengan nyalaan sekata, berwarna kemerahan. Selepas dibakar, air cair kekal. Metana yang diekstrak dengan cara ini mungkin merupakan alternatif yang baik kepada sumber hidrokarbon konvensional, tetapi ia juga merupakan ancaman kepada iklim. Masih kurang pengetahuan tentang eksploitasi metana daripada klatrat yang terkumpul di dasar lautan. Pembebasan dalam kuantiti yang banyak gas ini secara tidak terkawal boleh menjadi sangat berbahaya, kerana ia meningkatkan kesan rumah hijau dengan lebih kuat daripada karbon dioksida.
