Ini adalah kumpulan sebatian tak organik yang terbentuk daripada gabungan pelbagai unsur dengan oksigen. Formula amnya ialah X n O m , dengan "X" ialah sebarang unsur, "O" ialah oksigen, sentiasa dalam keadaan pengoksidaan kedua, dan huruf "n,m" dalam indeks bawah ialah pekali. Contoh oksida: air H 2 O, kalium oksida K 2 O, aluminium oksida Al 2 O 3 , kalsium oksida CaO dan karbon (II) monoksida CO.

Pengelasan oksida
Oksida boleh dikelaskan kepada beberapa kategori. Klasifikasi yang paling umum ialah perbezaan antara oksida logam, contohnya litium oksida, magnesium oksida, aluminium oksida, oksida besi, dan oksida bukan logam, termasuk karbon oksida, nitrogen oksida, sulfur oksida dan klorin oksida. Kriteria lain ialah pengelasan mengikut keadaan fizikal mereka. Hampir semua oksida logam dan beberapa bukan logam (SiO 2 , P 4 O 10 ) adalah pepejal. Air, sulfur (VI) oksida, dan mangan (VII) oksida adalah cecair. Oksida bukan logam seperti CO, CO 2 , SO 2 , NO i NO 2 ialah gas. Oksida juga boleh dikelaskan mengikut jenis ikatan yang berlaku di dalamnya. Magnesium oksida MgO, kalsium oksida CaO, atau natrium oksida Na 2 O mengandungi ion O 2- dan ikatan ionik, maka namanya – oksida ionik. Kumpulan lain ialah oksida kovalen, cth karbon (II) monoksida CO, nitrik (II) oksida NO atau sulfur (IV) oksida SO 2 , di mana ikatan antara atom oksigen dan unsur mempunyai bentuk ikatan kovalen polar.
Sifat kimia oksida
Bagi ahli kimia, klasifikasi yang paling menarik adalah berdasarkan sifat kimia oksida. Terdapat empat kategori utama oksida – berasid, asas, neutral dan amfoterik.
- Oksida berasid , kadang-kadang juga dipanggil anhidrida asid, dibezakan oleh fakta bahawa ia bertindak balas dengan alkali dengan pembentukan garam. Sebahagian besar oksida berasid membentuk larutan asid oksi yang sesuai selepas larut dalam air. Ini terpakai kepada, contohnya, sulfur (IV) oksida, yang apabila dilarutkan dalam air menghasilkan asid sulfurik (IV) , dan kepada kromium (VI) oksida yang larut kepada asid kromik (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Terdapat sekumpulan kecil oksida berasid yang tidak larut dalam air. Walau bagaimanapun, ia larut dalam larutan alkali kuat , contohnya silikon ( IV) oksida SiO 2 , molibdenum (VI) oksida MoO 3 , dan tungsten (VI) oksida WO 3 . Tindak balas mereka dengan alkali mengesahkan sifat berasid mereka: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O Sebagai a peraturan, oksida berasid ialah oksida bukan logam dan oksida logam pada keadaan pengoksidaan tertingginya. Jika unsur tertentu membentuk beberapa oksida pada keadaan pengoksidaan yang berbeza, seperti contohnya kromium, sifat berasid oksidanya meningkat dengan peningkatan keadaan pengoksidaannya:
- kromium (II) CrO oksida adalah beralkali,
- kromium (III) oksida Cr 2 O 3 mempunyai sifat amfoterik,
- kromium (VI) oksida CrO 3 adalah berasid.

- Oksida alkali ialah sebatian oksigen dengan logam yang bertindak balas dengan asid untuk menghasilkan produk dalam bentuk garam yang sepadan. Sebahagian daripadanya, iaitu oksida unsur daripada kumpulan pertama dan kedua jadual berkala, tidak termasuk berilium, juga dicirikan oleh tindak balas dengan air yang mengakibatkan pembentukan hidroksida alkali. Ia berlaku, contohnya, semasa tindak balas natrium oksida, litium oksida dan barium oksida dengan air:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Terdapat juga oksida alkali yang tidak larut dalam air tetapi hanya dalam larutan asid. Ini termasuk, cth, mangan (II) oksida dan besi (II) oksida: MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Oksida neutral ialah kumpulan oksida yang paling tidak reaktif. Mereka tidak bertindak balas dengan sama ada asid atau alkali. Mereka juga tidak larut dalam air. Contoh kumpulan oksida ini ialah karbon (II) monoksida CO dan nitrik (II) oksida NO.
- Oksida amfoterik adalah bertentangan sepenuhnya dengan oksida neutral dan kedua-duanya berasid dan beralkali pada masa yang sama. Ini bermakna mereka bertindak balas dengan kedua-dua alkali dan asid kuat. Hasil tindak balas ini sentiasa garam, dan unsur yang pada mulanya digabungkan dengan oksigen diubah menjadi kation atau anion yang sesuai bagi sisa asid. Satu-satunya persamaan dengan oksida neutral ialah keterlarutan yang lemah dalam air. Contoh oksida amfoterik ialah: berilium oksida BeO, aluminium oksida Al 2 O 3 , kromium (III) oksida, timah (II) oksida SnO, plumbum (II) oksida PbO, dan zink oksida ZnO. Dengan bertindak balas dengan larutan akueus alkali kuat, contohnya dengan larutan akueus natrium hidroksida , ia membentuk garam kompleks . Dalam sisa asidnya, atom atau ion logam, yang berasal daripada oksida, terdapat dalam kompleks dengan bilangan kumpulan hidroksil yang sesuai. Nombor mereka bergantung pada nombor koordinasi unsur yang diberikan. Contohnya, atom yang berasal daripada oksida MO (M – logam), seperti berilium oksida BeO, mempunyai nombor koordinasi 4. Atom yang diperoleh daripada jenis oksida M 2 O 3 , contohnya Al 2 O 3 , boleh mempunyai dua nombor koordinasi yang berbeza, dan bergantung kepada keadaan tindak balas ia adalah 4 atau 6. Contoh tindak balas oksida amfoterik:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] natrium tetrahidroksi zinkat Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] kalium tetrahidroksialuminat Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] natrium heksahidroksialuminat Beberapa oksida , seperti zink oksida dan mangan (IV) oksida, mempunyai sifat amfoterik yang agak spesifik. Yang terakhir, tidak dalam keadaan normal atau standard, tidak bertindak balas dengan alkali. Kedua-duanya, sebaliknya, bertindak balas dengan mereka dengan menggabungkan dengan alkali pepejal, cth: 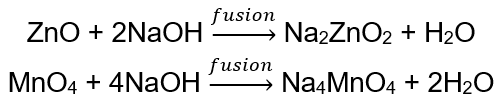

Mendapatkan oksida
- Sintesis langsung unsur: a) sintesis atom sulfur dan atom oksigen dengan pembentukan sulfur (IV) oksida S + O → SO 2 b) sintesis atom magnesium dan atom oksigen dengan pembentukan magnesium oksida 2Mg + O 2 → 2MgO c) sintesis atom karbon dan atom oksigen dengan pembentukan karbon (IV) monoksida C + O 2 → CO 2
- Penguraian terma garam , hidroksida dan oksida: a) penguraian kalsium karbonat kepada kalsium oksida dan karbon (IV) monoksida CaCO 3 → CaO + CO 2 b) penguraian kuprum (II) hidroksida kepada kuprum (II) oksida dan air Cu( OH) 2 → CuO + H 2 O c) penguraian mangan (IV) oksida kepada mangan (III) oksida dan oksigen 4MnO 2 → 2Mn 2 O 3 + O 2
- Pengoksidaan oksida pada keadaan pengoksidaan yang lebih rendah, dengan peningkatan valensnya: a) pengoksidaan sulfur (IV) oksida kepada sulfur (VI) oksida 2SO 2 + O 2 → 2SO 3 b) pengoksidaan nitrik (II) oksida kepada nitrik ( IV) oksida 2NO + O 2 → 2NO 2 c) pengoksidaan karbon (II) monoksida kepada karbon (IV) monoksida (IV) 2CO + O 2 → 2CO 2
- Pengurangan oksida pada keadaan pengoksidaan yang lebih tinggi, dengan penurunan valensinya: a) pengurangan karbon (IV) monoksida kepada karbon (II) monoksida (II) CO 2 + C → 2CO b) pengurangan timah (II) oksida kepada timah (I) oksida 2SnO + O 2 → 2SnO 2
- Pembakaran sebatian organik: a) pembakaran metana dalam oksigen dengan pembentukan karbon (IV) monoksida dan air CH 4 + 2O 2 → CO 2 + 2H 2 O b) pembakaran ammonia dalam oksigen untuk mendapatkan nitrik (II) oksida dan air 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Tindak balas asid oksi tidak stabil: a) penguraian asid karbonik (IV) kepada karbon (IV) monoksida dan air: H 2 CO 3 → CO 2 + H 2 O b) penguraian asid sulfurik (IV) kepada sulfur (IV) oksida dan air: H 2 SO 3 → SO 2 + H 2 O
