Pemisahan, dalam konteks kimia, bermaksud penguraian bahan kepada molekul lain. Perkataan itu berasal dari istilah Latin " dissociatio ", yang bermaksud "pemisahan". Dalam tatanama saintifik, disosiasi mempunyai pelbagai definisi, kerana ia juga mempunyai makna khusus dalam psikologi. Tetapi marilah kita fokus pada apa yang dimaksudkan dengan pemisahan dalam kimia. Bergantung pada perjalanan proses dan bahan yang digunakan, kita boleh membezakan empat jenis pemisahan yang berbeza. Yang paling popular ialah penceraian elektrolitik, walaupun penceraian haba adalah sama pentingnya.

Pemisahan terma
Proses ini terdiri daripada penguraian molekul menjadi molekul yang lebih kecil atau menjadi atom, di bawah pengaruh suhu. Hubungan yang paling penting ialah hakikat bahawa suhu yang digunakan untuk penceraian mungkin lebih rendah jika sebatian termasuk ikatan kimia yang lebih lemah. Yang mempunyai tenaga yang lebih tinggi yang diperlukan untuk penguraian memerlukan suhu yang lebih tinggi. Contoh biasa termolisis (penceraian terma) ialah karamelisasi sukrosa, yang berlaku pada 160 o C.
Pemisahan elektrolitik
Ditemui pada tahun 1887 oleh ahli kimia Sweden Svante Arrhenius, ia agak lebih kompleks berbanding dengan penceraian haba. Pemisahan elektrolitik terdiri daripada penguraian bahan, yang berlaku apabila pelarut (biasanya air) menjejaskan ion yang bergerak bebas. Arrhenius telah membuktikan dalam penyelidikannya bahawa ion yang dihasilkan oleh penceraian tersebut menyebabkan larutan mengalirkan elektrik. Ini adalah asas untuk membangunkan klasifikasi bahan kimia kepada elektrolit (larutan yang mampu mengalirkan arus elektrik) dan bukan elektrolit (larutan yang tidak mampu mengalirkan arus elektrik).
Elektrolit
Istilah "elektrolit" mempunyai dua makna -dari sudut pandangan teknikal, ia adalah sebarang bahan yang boleh memindahkan cas secara ion antara elektrod. Akibatnya, ia mungkin mengalirkan arus elektrik secara ion. Makna lain yang lebih kimia bagi istilah itu merujuk kepada bahan yang mengalami penceraian elektrolitik sebagai akibat daripada pencairan atau pembubaran. Penyelesaian sedemikian (paling kerap berair) juga mengalirkan elektrik. Contoh elektrolit tersebut termasuk sebatian ionik, seperti natrium klorida (garam meja), tetapi juga sebatian bukan ionik, contohnya asid hidroklorik atau kalium hidroksida . Memandangkan sifat khusus mereka, elektrolit boleh dipanggil konduktor elektrik. Ini boleh dibahagikan kepada konduktor kelas 1 (logam, aloinya, dan karbon) dan konduktor kelas 2 (larutan bes, asid dan garam ).
Mekanisme pemisahan elektrolitik
Dalam pelarut yang pemalar dielektriknya tinggi (cth, 81 untuk air), daya tarikan bersama antara ion dalam rangkaian hablur berkurangan dengan ketara. Ini adalah apabila ion terputus, yang menyebabkan bahan membubarkan dan merembeskan ion yang bergerak bebas ke dalam larutan. Proses sedemikian juga berlaku disebabkan oleh interaksi antara ion dan molekul air, yang merupakan akibat daripada struktur kutub H 2 O. Menurut Nekrasov, mekanisme tindakan air semasa penguraian elektrolit dengan struktur ionik dimulakan oleh ion positif bahan, yang menarik kutub bertentangan molekul air, pada masa yang sama menolak ion positif. Kutub bertentangan bertindak dengan cara yang sama, dan kedua-dua ion dikelilingi oleh molekul air yang telah mereka tarik. Daya tarikan sedemikian berlaku dalam kedua-dua arah antara molekul dipolar dan ion, yang menjadikan daya tarikan ion dalam elektrolit jauh lebih rendah. Oleh itu, mekanisme boleh dibahagikan kepada empat peringkat utama: peralihan kutub ke struktur ionik, pembentukan struktur ionik, dan penghidratan ion. Hubungan antara ion dan pelarut, yang dihasilkan melalui penceraian, dipanggil pelarut. Jika air adalah pelarut, maka ia dipanggil hidrat.
Cangkang penghidratan
Ia adalah cangkang yang terdiri daripada molekul air yang wujud dalam jarak terdekat ion, berorientasikan dengan kutub bertentangan mereka. Kutub bebas bercas menarik lapisan air lagi, sehingga daya tarikan ion menjadi lebih lemah daripada tenaga gerakan molekul dalam larutan. Cangkang memudahkan penguraian molekul elektrolit kepada kation dan anion, dan membentuk penghalang yang menghalang penyambungan semula ion untuk membentuk molekul. 
Pemisahan asid dan bes: hukum tindakan jisim
Asid kuat ialah asid yang menunjukkan penceraian yang meluas dalam larutan akueus, dan asid lemah ialah asid yang tercerai hanya pada tahap yang kecil. Jika kita membandingkan kekuatan asid yang berbeza, kita juga harus mengambil kira beberapa faktor seperti kecenderungan molekul asid untuk memberikan protonnya, atau kepekatan bahan yang dipersoalkan. Walau bagaimanapun, terdapat nilai kimia yang tidak bergantung pada kepekatan tetapi mencirikan sifat individu molekul dengan cemerlang – pemalar penceraian. Menerbitkan persamaan untuk nilai itu hendaklah dimulakan dengan menulis persamaan untuk penceraian asid . Untuk contoh dengan proton tunggal (HX), ia akan kelihatan seperti ini: ![]() Jika larutan dicairkan dan asid lemah, kita boleh menggunakan hukum tindakan jisim, yang dinyatakan seperti berikut:
Jika larutan dicairkan dan asid lemah, kita boleh menggunakan hukum tindakan jisim, yang dinyatakan seperti berikut: 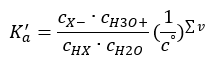 Terdapat dua cara untuk menjadikan perhubungan yang dibentangkan lebih pendek. Langkah pertama ialah mengandaikan bahawa kepekatan air adalah malar. Kita juga boleh meninggalkan simbol c o , kerana ia menyatakan kepekatan piawai bersamaan dengan 1 mol/dm 3 . Walau bagaimanapun, adalah penting untuk meletakkannya dalam formula awal dan mengambil kiranya semasa menentukan unit. Ini kerana pemalar kimia adalah nilai tanpa dimensi. Sementara itu, semua kepekatan yang digunakan dalam formula dinyatakan dalam mol/dm 3 . Kemudian kita akhirnya memperoleh formula untuk pemalar pemisahan:
Terdapat dua cara untuk menjadikan perhubungan yang dibentangkan lebih pendek. Langkah pertama ialah mengandaikan bahawa kepekatan air adalah malar. Kita juga boleh meninggalkan simbol c o , kerana ia menyatakan kepekatan piawai bersamaan dengan 1 mol/dm 3 . Walau bagaimanapun, adalah penting untuk meletakkannya dalam formula awal dan mengambil kiranya semasa menentukan unit. Ini kerana pemalar kimia adalah nilai tanpa dimensi. Sementara itu, semua kepekatan yang digunakan dalam formula dinyatakan dalam mol/dm 3 . Kemudian kita akhirnya memperoleh formula untuk pemalar pemisahan: 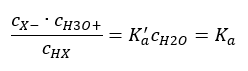 Hubungan yang menyatakan pemalar pemisahan asid (K a ) terdiri daripada nilai yang ditentukan oleh eksperimen, yang berada dalam julat 10 -10 hingga 10 8 . Operasi yang popular ialah menggunakan formula logaritma, dinyatakan sebagai logaritma negatif pemalar penceraian, ditetapkan sebagai pK a : pK a = -logK a Adalah penting walaupun nilai K a rendah mewakili asid lemah, dan nilai tinggi mewakili asid kuat , pK a berubah dengan cara yang bertentangan. Nilai pK a yang rendah, biasanya negatif sepadan dengan asid kuat. Nilai pK a yang positif dan tinggi mewakili asid lemah. Apabila kita memperkenalkan konsep lain, darjah pemisahan (α), iaitu nisbah bilangan mol molekul sebatian tertentu, yang mengalami penceraian (penguraian menjadi ion), kepada jumlah bilangan mol molekul sebatian itu, yang terdapat dalam larutan, kita boleh membangunkan lagi persamaan itu. Jika kita mengabaikan kepekatan ion hidrogen yang sangat rendah yang terbentuk oleh penceraian air, dan menggunakan kepekatan keseimbangan ion dan molekul, kita boleh menganggap bahawa:
Hubungan yang menyatakan pemalar pemisahan asid (K a ) terdiri daripada nilai yang ditentukan oleh eksperimen, yang berada dalam julat 10 -10 hingga 10 8 . Operasi yang popular ialah menggunakan formula logaritma, dinyatakan sebagai logaritma negatif pemalar penceraian, ditetapkan sebagai pK a : pK a = -logK a Adalah penting walaupun nilai K a rendah mewakili asid lemah, dan nilai tinggi mewakili asid kuat , pK a berubah dengan cara yang bertentangan. Nilai pK a yang rendah, biasanya negatif sepadan dengan asid kuat. Nilai pK a yang positif dan tinggi mewakili asid lemah. Apabila kita memperkenalkan konsep lain, darjah pemisahan (α), iaitu nisbah bilangan mol molekul sebatian tertentu, yang mengalami penceraian (penguraian menjadi ion), kepada jumlah bilangan mol molekul sebatian itu, yang terdapat dalam larutan, kita boleh membangunkan lagi persamaan itu. Jika kita mengabaikan kepekatan ion hidrogen yang sangat rendah yang terbentuk oleh penceraian air, dan menggunakan kepekatan keseimbangan ion dan molekul, kita boleh menganggap bahawa: 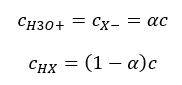 Kemudian pemalar pemisahan boleh diperhatikan seperti berikut:
Kemudian pemalar pemisahan boleh diperhatikan seperti berikut:  Dalam bentuk ini, ia adalah pergantungan tahap penceraian elektrolit daripada kepekatannya, iaitu, hukum pencairan Ostwald. Jika kita menganalisis elektrolit yang sangat lemah, tahap pemisahan (α) boleh diandaikan sebagai <<1, dan formula boleh dipermudahkan kepada yang berikut:
Dalam bentuk ini, ia adalah pergantungan tahap penceraian elektrolit daripada kepekatannya, iaitu, hukum pencairan Ostwald. Jika kita menganalisis elektrolit yang sangat lemah, tahap pemisahan (α) boleh diandaikan sebagai <<1, dan formula boleh dipermudahkan kepada yang berikut:  Asid yang mengandungi lebih daripada satu proton mengalami pemisahan berbilang peringkat, dan kita mesti mengambil kira semua peringkatnya. Sebagai contoh, untuk asid ortofosforik terdapat tiga peringkat:
Asid yang mengandungi lebih daripada satu proton mengalami pemisahan berbilang peringkat, dan kita mesti mengambil kira semua peringkatnya. Sebagai contoh, untuk asid ortofosforik terdapat tiga peringkat:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Setiap peringkat mempunyai pemalar keseimbangan sendiri, yang boleh diperhatikan secara analog dengan yang pertama:  Pemalar pemisahan dijadualkan, kedua-dua untuk hidrasid dan untuk asid oksi.
Pemalar pemisahan dijadualkan, kedua-dua untuk hidrasid dan untuk asid oksi.
| Asid | K a | pK a |
| HF | 6,3·10 -4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27.54 | -1.44 |
| H 3 PO 4 | 6.9·10 -3 | 2.16 |
Jadual 1. Contoh nilai pemalar penceraian bagi asid. Ia adalah serupa untuk penstabilan keseimbangan bes semasa penceraian. Mempertimbangkan contoh peraturan B, persamaan boleh diperhatikan seperti berikut: ![]() Kemudian, jika kita ingin memperoleh pemalar penceraian untuk asas, menggunakan hukum tindakan jisim dan mengandaikan bahawa kepekatan air dalam larutan yang dicairkan adalah hampir malar, kita memperoleh formula berikut:
Kemudian, jika kita ingin memperoleh pemalar penceraian untuk asas, menggunakan hukum tindakan jisim dan mengandaikan bahawa kepekatan air dalam larutan yang dicairkan adalah hampir malar, kita memperoleh formula berikut:  Semakin kuat asas, semakin tinggi pemalar pemisahan dan semakin rendah nilai pK b , manakala semakin rendah pemalar penceraian dan semakin tinggi nilai pK b , semakin lemah asas.
Semakin kuat asas, semakin tinggi pemalar pemisahan dan semakin rendah nilai pK b , manakala semakin rendah pemalar penceraian dan semakin tinggi nilai pK b , semakin lemah asas.
| Pangkalan | K b | pK b |
| Hidrazin | 3·10 -6 | 5.5 |
| Ammonia | 1.78·10 -5 | 4.75 |
| Methylamine | 5.0·10 -4 | 3.3 |
Jadual 2. Contoh nilai pemalar penceraian untuk asas. 
Apa yang menentukan kekuatan asid
Jika kita mengetahui ungkapan pemalar pemisahan untuk asid tertentu, kita boleh membuat beberapa andaian yang benar:
- Kekuatan hidrasid bertambah seiring dengan peningkatan nombor atom unsur yang dikaitkan dengan atom hidrogen.
- Kekuatan hidrasid merosot seiring dengan peningkatan keelektronegatifan unsur yang melekat pada atom hidrogen. Ini mungkin mengelirukan, kerana dalam teori peningkatan keelektronegatifan harus memihak kepada abstraksi proton.
- Saiz anion yang terbentuk semasa penceraian mempengaruhi pemalar penceraian pada tahap yang lebih besar daripada keelektronegatifan.
Pemisahan diri air
Contoh penceraian yang menarik ialah penguraian molekul air. Oleh kerana mereka mampu menarik proton dan melepaskannya, air tulen mengalami pemisahan diri sedikit sebanyak, seperti persamaan berikut: H 2 O + H 2 O ↔ H 3 O + + OH – Seperti untuk asid dan bes, adalah mungkin juga untuk menggunakan hukum tindakan jisim, yang merangkumi kepekatan keseimbangan air tidak tercerai serta anion dan kationnya: 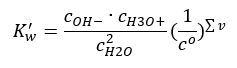 Ternyata kepekatan kation H 3 O + dan anion OH – adalah sangat kecil berbanding dengan air tidak tercerai sehinggakan perubahannya secara praktikal tidak mengubah kepekatan air tidak tercerai. Ini memungkinkan untuk mengandaikan nilai itu menjadi malar dan menukar persamaan kepada bentuk berikut: K w = c OH – · c H3O + Ia merupakan aspek yang sangat penting dalam konteks pengiraan kimia, dan pemalar sedemikian dirujuk sebagai hasil ion air. Ia juga sering digunakan sebagai logaritma negatif, ditetapkan sebagai pK w . Ini sama dengan –logK w . Berdasarkan persamaan, jika keseimbangan ionik air terganggu akibat membekalkan ion H 3 O + , maka untuk mengekalkan kemalaran hasil ionik kita mesti mengurangkan kepekatan ion OH – . Begitu juga, lebihan ion OH – mengurangkan kepekatan kation. Hasil daripada kepekatan ini mestilah malar. Eksperimen telah menunjukkan bahawa K w pada suhu 298K ialah 10 -14 . Oleh itu, kita juga boleh perhatikan persamaan yang sah untuk air tulen seperti berikut:
Ternyata kepekatan kation H 3 O + dan anion OH – adalah sangat kecil berbanding dengan air tidak tercerai sehinggakan perubahannya secara praktikal tidak mengubah kepekatan air tidak tercerai. Ini memungkinkan untuk mengandaikan nilai itu menjadi malar dan menukar persamaan kepada bentuk berikut: K w = c OH – · c H3O + Ia merupakan aspek yang sangat penting dalam konteks pengiraan kimia, dan pemalar sedemikian dirujuk sebagai hasil ion air. Ia juga sering digunakan sebagai logaritma negatif, ditetapkan sebagai pK w . Ini sama dengan –logK w . Berdasarkan persamaan, jika keseimbangan ionik air terganggu akibat membekalkan ion H 3 O + , maka untuk mengekalkan kemalaran hasil ionik kita mesti mengurangkan kepekatan ion OH – . Begitu juga, lebihan ion OH – mengurangkan kepekatan kation. Hasil daripada kepekatan ini mestilah malar. Eksperimen telah menunjukkan bahawa K w pada suhu 298K ialah 10 -14 . Oleh itu, kita juga boleh perhatikan persamaan yang sah untuk air tulen seperti berikut:  Pemisahan juga berkaitan dengan nilai pH larutan. Larutan dengan kepekatan yang sama bagi kation H 3 O + dan anion OH – menunjukkan pH neutral. Dalam larutan berasid kepekatan kation lebih tinggi daripada 10 -7 mol/l, manakala dalam larutan alkali ia lebih rendah daripada 10 -7 mol/l.
Pemisahan juga berkaitan dengan nilai pH larutan. Larutan dengan kepekatan yang sama bagi kation H 3 O + dan anion OH – menunjukkan pH neutral. Dalam larutan berasid kepekatan kation lebih tinggi daripada 10 -7 mol/l, manakala dalam larutan alkali ia lebih rendah daripada 10 -7 mol/l.
