Istilah "penampan pH" merujuk kepada larutan berair sedemikian yang tidak mengubah nilai pHnya walaupun memasukkan sejumlah kecil bes atau asid, atau semasa pencairan. Dari segi praktikal, ia adalah campuran larutan asid lemah dan garamnya dengan bes kuat pekat (penderma proton –penerima proton) atau, secara analogi, campuran larutan bes lemah dan garamnya dengan asid kuat. Matlamat utama menggunakan larutan penimbal ialah ia bertindak sebagai agen yang membolehkan mengekalkan nilai pH pada tahap yang agak stabil. Ia sering digunakan dalam pelbagai aplikasi kimia, contohnya dalam pembuatan pewarna, semasa proses penapaian, serta untuk menentukan nilai pH produk makanan, kosmetik dan farmaseutikal.
Persamaan Henderson-Hasselbach
Kebergantungan utama nilai pH penimbal pada pK a atau pK b yang digunakan untuk asid atau bes, masing-masing, serta nisbah kepekatan asid dan bes konjugatnya atau, secara analog, bes dan asid konjugatnya, ialah ditakrifkan oleh persamaan Henderson-Hasselbach. Ia menunjukkan korelasi antara kekuatan asid yang digunakan dengan nilai pH. Bagi sampel tindak balas penimbal yang dihasilkan menggunakan asid lemah, prosedurnya adalah seperti berikut: HA + H 2 O ↔ H 3 O + + A – Manakala korelasi antara [A –], iaitu kepekatan molar daripada bes konjugat [mol ·dm -3], [HA], sebagai kepekatan molar bagi asid tak tercerai dan pK a – logaritma negatif pemalar penceraian keseimbangan asid (K a ), dinyatakan dengan persamaan Henderson-Hasselbach untuk tindak balas sedemikian, mempunyai bentuk berikut: 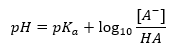
Persamaan Henderson-Hasselbach untuk penimbal asetat
Mekanisme operasi penimbal adalah berdasarkan kehadiran ion, yang mampu mengikat ion hidrogen atau hidroksida. Apabila mempertimbangkan penimbal asetat, yang merupakan campuran asid asetik dan natrium asetat, kita harus mencatatkan tindak balas pemisahan antara asid asetik lemah dan elektrolit kuat, natrium asetat (CH 3 COONa), yang tercerai sepenuhnya menjadi ion: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Oleh kerana larutan penimbal ialah campuran ion-ion ini, penambahan sejumlah kecil asid kuat memperkenalkan [H + } } ion, yang segera diikat oleh CH 3 COO – anion untuk membentuk asid asetik yang tidak terurai dalam keadaan ini. Akibatnya, ini mengurangkan nilai pH. Dengan cara yang sama, bekalan kation OH – tambahan dengan memasukkan bes yang kuat kepada larutan tidak akan meningkatkan tahap pH. Mereka akan segera diikat oleh ion H + yang berasal daripada penceraian asid asetik kepada molekul air yang tidak tercerai. Persamaan yang mentakrifkan pemalar penceraian asid dibentangkan di bawah: 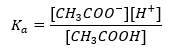 Untuk penceraian asid asetik lemah, jumlah kepekatan CH 3 COO – anion ditakrifkan oleh kepekatan ion yang berasal daripada penceraian garam, yang seterusnya, adalah sama dengan kepekatan garam (c s ), iaitu natrium asetat. Kepekatan tinggi anion ini menyebabkan kepekatan kation H + merosot dan, akibatnya, darjah disosiasi asid dikurangkan untuk memastikan nilai K a stabil. Disebabkan oleh hubungan ini, kita juga boleh mengandaikan bahawa bilangan molekul CH 3 COOH yang tidak tercerai hampir sama dengan jumlah kepekatan asid asetik (c k ). Inilah sebabnya mengapa pemalar pemisahan boleh dicatatkan seperti berikut:
Untuk penceraian asid asetik lemah, jumlah kepekatan CH 3 COO – anion ditakrifkan oleh kepekatan ion yang berasal daripada penceraian garam, yang seterusnya, adalah sama dengan kepekatan garam (c s ), iaitu natrium asetat. Kepekatan tinggi anion ini menyebabkan kepekatan kation H + merosot dan, akibatnya, darjah disosiasi asid dikurangkan untuk memastikan nilai K a stabil. Disebabkan oleh hubungan ini, kita juga boleh mengandaikan bahawa bilangan molekul CH 3 COOH yang tidak tercerai hampir sama dengan jumlah kepekatan asid asetik (c k ). Inilah sebabnya mengapa pemalar pemisahan boleh dicatatkan seperti berikut: 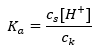 Setelah mengambil logaritma, kami memperoleh hubungan yang membawa kepada persamaan Henderson-Hasselbach:
Setelah mengambil logaritma, kami memperoleh hubungan yang membawa kepada persamaan Henderson-Hasselbach: 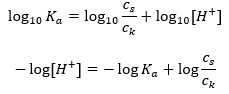 Oleh itu, persamaan Henderson-Hasselbach mempunyai bentuk berikut:
Oleh itu, persamaan Henderson-Hasselbach mempunyai bentuk berikut: 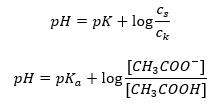 Untuk menulis hubungan, nilai pK a dalam persamaan sebenarnya adalah ukuran kekuatan asid. Mana-mana nilai pK a yang lebih rendah daripada 3 (-log(0.001)) adalah ciri asid kuat, manakala semakin tinggi nilai, semakin lemah asid. Fakta yang terhasil daripada persamaan Henderson-Hasselbach ialah kesetaraan nilai pH larutan penampan dan pK a asid pada masa apabila nisbah kepekatan asid tidak terurai dan kepekatan anion yang dihasilkan oleh penceraian daripada asid sama dengan 1, kerana log(1) sama dengan 0. Keadaan sedemikian wujud akibat daripada mentitrasi asid lemah dengan bes kuat, jika kita menambah jumlah bes yang sepadan dengan separuh jumlah yang diperlukan untuk peneutralan lengkap daripada asid. Kemudian darjah titrasi larutan ialah 50%. Dalam kebergantungan antara pH dan isipadu titran yang digunakan, nilai pH di kawasan penimbal berubah secara agak perlahan.
Untuk menulis hubungan, nilai pK a dalam persamaan sebenarnya adalah ukuran kekuatan asid. Mana-mana nilai pK a yang lebih rendah daripada 3 (-log(0.001)) adalah ciri asid kuat, manakala semakin tinggi nilai, semakin lemah asid. Fakta yang terhasil daripada persamaan Henderson-Hasselbach ialah kesetaraan nilai pH larutan penampan dan pK a asid pada masa apabila nisbah kepekatan asid tidak terurai dan kepekatan anion yang dihasilkan oleh penceraian daripada asid sama dengan 1, kerana log(1) sama dengan 0. Keadaan sedemikian wujud akibat daripada mentitrasi asid lemah dengan bes kuat, jika kita menambah jumlah bes yang sepadan dengan separuh jumlah yang diperlukan untuk peneutralan lengkap daripada asid. Kemudian darjah titrasi larutan ialah 50%. Dalam kebergantungan antara pH dan isipadu titran yang digunakan, nilai pH di kawasan penimbal berubah secara agak perlahan. 
Contoh: penimbal ammonium
Satu lagi jenis penimbal ialah penimbal ammonium, iaitu campuran bes lemah (NH 4 OH) dengan asid kuat (NH 4 Cl). Walau bagaimanapun, mekanismenya sangat serupa. Garam yang terdapat dalam campuran mengalami penceraian lengkap, dan pemalarnya ialah persamaan berikut: 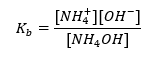 Manakala bes ammonium secara praktikalnya tidak tercerai dalam elektrolit kuat (NH 4 Cl). Atas sebab ini, kami menganggap bahawa kepekatan kation NH 4 + adalah sama dengan kepekatan garam, tetapi kepekatan molekul NH 4 OH yang tidak tercerai adalah sama dengan kepekatan bes. Ini memungkinkan untuk merumuskan persamaan dan mengira pH penimbal itu.
Manakala bes ammonium secara praktikalnya tidak tercerai dalam elektrolit kuat (NH 4 Cl). Atas sebab ini, kami menganggap bahawa kepekatan kation NH 4 + adalah sama dengan kepekatan garam, tetapi kepekatan molekul NH 4 OH yang tidak tercerai adalah sama dengan kepekatan bes. Ini memungkinkan untuk merumuskan persamaan dan mengira pH penimbal itu. 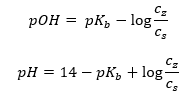 Molekul NH 4 + dan Cl – , dan NH 4 OH yang terdapat dalam penimbal ammonium menghasilkan fakta bahawa sebaik sahaja kita menambah asid atau bes, tindak balas berikut berlaku: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Jika penambahannya kecil, perubahan nisbah kepekatan garam bes, dan dengan itu perubahan pH, juga kecil. Sekiranya berlaku perubahan sepuluh kali ganda dalam nisbah kepekatan ini, nilai pH akan berubah sebanyak satu unit.
Molekul NH 4 + dan Cl – , dan NH 4 OH yang terdapat dalam penimbal ammonium menghasilkan fakta bahawa sebaik sahaja kita menambah asid atau bes, tindak balas berikut berlaku: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Jika penambahannya kecil, perubahan nisbah kepekatan garam bes, dan dengan itu perubahan pH, juga kecil. Sekiranya berlaku perubahan sepuluh kali ganda dalam nisbah kepekatan ini, nilai pH akan berubah sebanyak satu unit.
Kapasiti penampan
Istilah” kapasiti penimbal” merujuk kepada kapasiti larutan penimbal untuk mengekalkan keasidan yang lebih kurang malar bagi larutan. Lebih tepat lagi, ia ialah bilangan gram-setara bagi asid kuat atau bes kuat yang, apabila ditambah kepada 1 dm 3 larutan penimbal, menukar nilai pHnya sebanyak satu. Formula yang mentakrifkan kapasiti penampan (β) termasuk pergantungannya pada bilangan mol asid/bes kuat selepas penambahan kepada larutan penimbal (Δn, [ml]) dan perubahan dalam pH yang diperhatikan semasa menambah isipadu asid atau bes kuat kepada larutan penimbal (ΔpH). ![]() Ia adalah nilai yang sangat berkaitan dengan kepekatan bahan-bahan, yang meningkat apabila ia meningkat. Nilai tertinggi kapasiti penimbal mencirikan larutan penimbal yang pHnya sama dengan pemalar penceraian (pK a ) asid yang digunakan untuk menghasilkannya.
Ia adalah nilai yang sangat berkaitan dengan kepekatan bahan-bahan, yang meningkat apabila ia meningkat. Nilai tertinggi kapasiti penimbal mencirikan larutan penimbal yang pHnya sama dengan pemalar penceraian (pK a ) asid yang digunakan untuk menghasilkannya.
Prinsip operasi penimbal fosfat
Jenis penimbal yang kurang popular ialah penimbal yang mengandungi dua garam asid. Dalam kes ini, ia adalah dua garam asid bagi asid ortofosforik (V), iaitu natrium fosfat monobes (V) dan natrium fosfat dibasic (V). Tidak seperti penimbal yang paling biasa, yang juga berdasarkan prinsip Brønsted pasangan asid-bes konjugat, sifat bahan tidak begitu mudah untuk ditentukan. Oleh kerana anion yang terdapat dalam penimbal fosfat menunjukkan nilai ciri asid Brønsted, kita harus menyemak perbezaan antara mereka dengan lebih berhati-hati. Mengikut prinsip itu, ion sebagai asid yang lebih kuat mesti mempunyai pemalar pemisahan yang lebih tinggi.
- Untuk H 2 PO 4 – K a = 6.34·10 -8
- Untuk HPO 4 -2 K a = 4.36·10 -13
Jika kita mempunyai data sedemikian, kita boleh dengan mudah menyatakan bahawa dalam kes ini, anion hidrogen H 2 PO 4 -13 ialah asid Brønsted yang lemah. Mekanisme operasi penimbal adalah berdasarkan keseimbangan dinamik yang boleh dinyatakan dengan persamaan berikut: ![]() Jika kita menambah sedikit asid ke dalam larutan penimbal, sistem akan cuba menghalang perubahan pH akibat tindak balas menyekat kesan kation [H +] dengan memprotonasi anion hidrogen, mengikut yang berikut. persamaan:
Jika kita menambah sedikit asid ke dalam larutan penimbal, sistem akan cuba menghalang perubahan pH akibat tindak balas menyekat kesan kation [H +] dengan memprotonasi anion hidrogen, mengikut yang berikut. persamaan: ![]() Hakikat bahawa anion yang akan meneutralkan penimbal yang ditambahkan pada larutan adalah akibat daripada fakta bahawa anion adalah asas Brønsted yang lebih kuat. Dalam sistem sedemikian, kami menggunakan peraturan yang menyatakan bahawa semakin kuat asid Brønsted, semakin lemah bes konjugatnya. Jika kita menambah asid pada sistem yang mengandungi beberapa bes Brønsted, maka bes terkuat akan menjadi yang pertama bertindak balas. Hubungan ini merupakan komponen terpenting apabila menganalisis keseimbangan yang wujud dalam campuran larutan penimbal akueus yang terdiri daripada campuran asid Brønsted dan campuran bes Brønsted yang lemah. Peraturan yang sama, tetapi dalam susunan terbalik, terpakai apabila kita menambah larutan asas ke dalam penimbal fosfat. Anion OH – akan hampir serta-merta ditangkap oleh asid Brønsted yang lebih kuat yang terdapat dalam penimbal. Dalam kes ini, ini akan menjadi ion, dan tindak balas akan berlaku mengikut persamaan berikut:
Hakikat bahawa anion yang akan meneutralkan penimbal yang ditambahkan pada larutan adalah akibat daripada fakta bahawa anion adalah asas Brønsted yang lebih kuat. Dalam sistem sedemikian, kami menggunakan peraturan yang menyatakan bahawa semakin kuat asid Brønsted, semakin lemah bes konjugatnya. Jika kita menambah asid pada sistem yang mengandungi beberapa bes Brønsted, maka bes terkuat akan menjadi yang pertama bertindak balas. Hubungan ini merupakan komponen terpenting apabila menganalisis keseimbangan yang wujud dalam campuran larutan penimbal akueus yang terdiri daripada campuran asid Brønsted dan campuran bes Brønsted yang lemah. Peraturan yang sama, tetapi dalam susunan terbalik, terpakai apabila kita menambah larutan asas ke dalam penimbal fosfat. Anion OH – akan hampir serta-merta ditangkap oleh asid Brønsted yang lebih kuat yang terdapat dalam penimbal. Dalam kes ini, ini akan menjadi ion, dan tindak balas akan berlaku mengikut persamaan berikut: ![]()
Penampan yang diketahui dan aplikasinya
- Darah mengekalkan nilai 7.35 dan 7.45 unit, dan kestabilannya dijamin oleh kehadiran asid karbonik, terutamanya dalam bentuk karbon dioksida terlarut dan HCO 3- Ia adalah penampan yang merupakan asid lemah dan garamnya, dan sebarang penambahan jumlah asid atau bes yang berlebihan akan menyebabkan keadaan berbahaya kepada kehidupan manusia. Contoh penimbal yang serupa ialah air liur, yang pHnya sekitar 7.
- Penampan ammonium, asetat, fosfat dan borat, masing-masing:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Semua penimbal popular digunakan di mana penting untuk mengekalkan pH pada tahap malar, jadi sebagai contoh:
- dalam bidang perubatan, di mana ia diberikan secara intravena kepada pesakit dalam keadaan kritikal;
- dalam kultur mikrob, di mana tindak balas tanah adalah faktor penting;
- dalam bekerja dengan enzim dan protein, untuk menstabilkan persekitaran untuk tindak balas kimia;
- dalam penyaduran elektrik, di mana ia digunakan untuk mandian elektrolitik, kerana ia membolehkan pencegahan perubahan cepat dan kritikal dalam pH mereka di kawasan berhampiran elektrod;
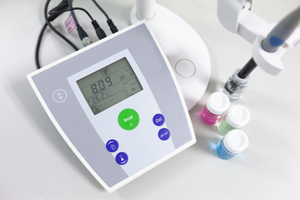
- untuk menentukur pH meter.
