Skala pH digunakan untuk menentukan tahap keasidan atau kealkalian larutan pada skala kuantitatif yang mengandungi nombor mutlak dari 0 hingga 14. Ia adalah berdasarkan aktiviti molar ion hidronium [H 3 O +] dalam cecair yang diuji. Skala ini dibangunkan pada tahun 1909 oleh ahli biokimia Denmark S. Sorensen, dan huruf 'p' dan 'H' masing-masing bermaksud, 'potentio' (kuasa) Latin dan atom hidrogen, yang dilambangkan dalam jadual berkala sebagai 'H' (hidrogenium). Skala pH mencerminkan kedua-dua satu dan yang lain: untuk menentukan tahap pH, kami menggunakan eksponen kuasa dengan tanda berubah untuk merujuk kepada proton yang mengandungi hidrogen. Tahap pH bagi sebarang larutan yang dihasilkan adalah salah satu ciri kimia yang paling penting dan faktor yang menentukan perjalanan dan kelajuan banyak tindak balas kimia serta jenis bahan yang dihasilkan.

Pembezaan pada skala
Skala pH termasuk lima belas darjah, di mana nilai tengah (7) menunjukkan pH neutral. Penyelesaian yang diletakkan berhampiran dengan 0 dipanggil asid kuat, manakala yang berada di bahagian bertentangan, hampir dengan 14, dirujuk sebagai bes kuat. pH berasid bermakna bahawa larutan mengandungi terlalu banyak ion hidrogen [H 3 O +], dan pH asas bermakna terdapat terlalu banyak ion hidroksida [OH –]. Skala pH paling kerap dirujuk dalam konteks penyelesaian, tetapi potensi kimia mutlak proton menjadikannya terpakai dalam semua keadaan pengagregatan. Ini membolehkan kita membandingkan secara langsung tahap kealkalian hampir mana-mana bahan.
Pemisahan diri air
Untuk memahami sepenuhnya pengertian skala pH, kita memerlukan tindak balas spontan pemisahan diri air, yang berjalan mengikut persamaan berikut:  Ia adalah proses boleh balik yang pemalar keseimbangan dialihkan ke sebelah kiri persamaan, iaitu, ke arah air yang tidak bercampur.
Ia adalah proses boleh balik yang pemalar keseimbangan dialihkan ke sebelah kiri persamaan, iaitu, ke arah air yang tidak bercampur.
Bagaimana untuk mengira tahap pH?
Walaupun andaian awal yang ditakrifkan secara salah bahawa penentuan berkenaan dengan kepekatan ion hidrogen [H +], formula yang paling popular masih seperti berikut:  Hari ini kita sudah tahu bahawa larutan tidak mengandungi ion hidrogen akueus, iaitu, proton yang terdapat dalam air, disebabkan oleh proses pelarutan yang segera. Fenomena ini mengakibatkan kekurangan proton bebas dan kehadiran ion hidronium [H 3 O +], yang disebabkan oleh tindak balas spontan yang tidak dapat dipulihkan:
Hari ini kita sudah tahu bahawa larutan tidak mengandungi ion hidrogen akueus, iaitu, proton yang terdapat dalam air, disebabkan oleh proses pelarutan yang segera. Fenomena ini mengakibatkan kekurangan proton bebas dan kehadiran ion hidronium [H 3 O +], yang disebabkan oleh tindak balas spontan yang tidak dapat dipulihkan: 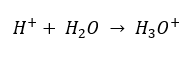 Oleh itu, tatatanda formula yang betul adalah seperti berikut:
Oleh itu, tatatanda formula yang betul adalah seperti berikut: 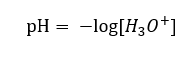
Persekitaran dilambangkan pada skala pH
Diandaikan bahawa kepekatan ion hidronium dalam air tulen pada suhu bilik (25 o C) ialah 10 -7 mol/dm 3 , jadi tahap pHnya boleh dikira seperti berikut: 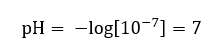 Ini adalah selaras dengan fakta bahawa air, sebagai neutral, diletakkan di tengah-tengah skala, yang menunjukkan kelonggaran kimia bahan. Ia juga membuktikan bahawa air mengandungi bilangan anion hidroksida dan kation hidronium yang sama. Dalam asid dan bes, bagaimanapun, keseimbangan itu terganggu. Eksponen negatif mencadangkan hubungan di mana semakin rendah tahap pH, semakin tinggi kuasa larutan yang diuji. Istilah ‘kuasa’ dalam konteks skala pH merujuk kepada fakta bahawa nilai 0 diambil oleh asid yang kuat, malah merengsa, manakala nilai 14 merujuk kepada bahan alkali terkuat.
Ini adalah selaras dengan fakta bahawa air, sebagai neutral, diletakkan di tengah-tengah skala, yang menunjukkan kelonggaran kimia bahan. Ia juga membuktikan bahawa air mengandungi bilangan anion hidroksida dan kation hidronium yang sama. Dalam asid dan bes, bagaimanapun, keseimbangan itu terganggu. Eksponen negatif mencadangkan hubungan di mana semakin rendah tahap pH, semakin tinggi kuasa larutan yang diuji. Istilah ‘kuasa’ dalam konteks skala pH merujuk kepada fakta bahawa nilai 0 diambil oleh asid yang kuat, malah merengsa, manakala nilai 14 merujuk kepada bahan alkali terkuat.
Penambahan asid ke dalam air
Perubahan pH daripada paras neutral boleh disebabkan oleh penambahan bahan yang berlainan kuasa. Sebagai contoh, jika kita menambah salah satu asid terkuat ( asid hidroklorik, HCl ) ke dalam air, ia akan menyebabkan asid tercerai mengikut tindak balas berikut:  Tidak seperti pemisahan diri air, keseimbangan penceraian asid dialihkan dengan ketara ke kanan. Oleh itu, jika asid itu dibubarkan dalam air lengai alam sekitar, ia akan meningkatkan kuantiti ion hidronium yang terdapat dalam air dan, akibatnya, meningkatkan aktiviti molar mereka. Untuk memberi contoh, mengikut tindak balas penceraian, asid hidroklorik pekat pada 1 mol/dm 3 memperkenalkan kepada larutan ion hidronium pekat pada 1mol/dm 3 . Tahap pH bagi larutan asid hidroklorik tersebut boleh dikira berdasarkan formula berikut:
Tidak seperti pemisahan diri air, keseimbangan penceraian asid dialihkan dengan ketara ke kanan. Oleh itu, jika asid itu dibubarkan dalam air lengai alam sekitar, ia akan meningkatkan kuantiti ion hidronium yang terdapat dalam air dan, akibatnya, meningkatkan aktiviti molar mereka. Untuk memberi contoh, mengikut tindak balas penceraian, asid hidroklorik pekat pada 1 mol/dm 3 memperkenalkan kepada larutan ion hidronium pekat pada 1mol/dm 3 . Tahap pH bagi larutan asid hidroklorik tersebut boleh dikira berdasarkan formula berikut: 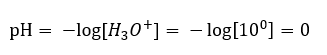
Penambahan asas ke dalam air
Dalam kejadian sebaliknya, di mana kita menambah bes yang kuat ke dalam air, kepekatan ion hidronium akan menurun. Sebagai contoh, natrium hidroksida tertumpu pada 1mol/dm 3 akan, secara analogi, mempunyai kepekatan yang sama tetapi dengan ion lain (ion hidroksida), mengikut tindak balas yang dilaluinya di bawah pengaruh air:  Dalam kes sedemikian, adalah mungkin untuk mengira pH secara tidak langsung menggunakan formula pOH tambahan berikut:
Dalam kes sedemikian, adalah mungkin untuk mengira pH secara tidak langsung menggunakan formula pOH tambahan berikut: 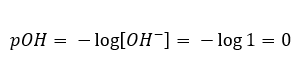 Jika kita tahu bahawa:
Jika kita tahu bahawa: 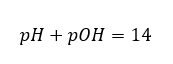 kita boleh mengira dengan mudah bahawa pH larutan bes kuat (NaOH) yang tertumpu pada 1 mol/dm 3 mempunyai pH 14.
kita boleh mengira dengan mudah bahawa pH larutan bes kuat (NaOH) yang tertumpu pada 1 mol/dm 3 mempunyai pH 14. 
Tahap pH di luar skala?
Oleh kerana skala pH pada asalnya dibangunkan untuk tujuan larutan yang dicairkan, ada kemungkinan asid atau bes kuat melebihinya, berada di bawah 0 atau melebihi 14. Ini kerana skala tidak berguna untuk kepekatan tinggi di mana pH tidak lagi logaritma. fungsi ion hidronium [H 3 O +]. Kemudian kita menggunakan nilai yang berbeza, yang timbul daripada keseimbangan berterusan penceraian asid dan bes.
Kaedah menentukan nilai pH larutan
Untuk menentukan pH persekitaran secara empirik, kita menggunakan penunjuk asid-bes yang dipanggil. Dalam amalan, ia adalah bahan yang berubah warna apabila dipengaruhi oleh keadaan pH yang berbeza. Terdapat tiga jenis penunjuk sedemikian:
- Penunjuk yang menukar warnanya dalam persekitaran asas, contohnya:
- fenolftalein tidak berwarna menjadi berwarna raspberi,
- thymolphtalein tidak berwarna bertukar menjadi biru.
- Penunjuk yang menukar warnanya dalam persekitaran berasid, contohnya:
- metil oren menukar warnanya daripada oren kepada merah,
- bromothymol blue bertukar warna daripada biru kepada kuning.
- Penunjuk universal, contohnya:
- biru bromothymol bertukar kuning dalam asid dan biru dalam bes,
- lakmus bertukar merah dalam asid atau biru dalam bes.
Ia juga biasa untuk merendam kertas litmus dalam campuran bahan penunjuk yang berbeza, yang meningkatkan julat tahap pH. Selain itu, banyak makmal menggunakan kertas litmus universal siap pakai yang menukar warna dalam julat daripada merah ke hijau, dengan sewajarnya mencadangkan pH yang diuji berdasarkan skala yang disertakan. Penentuan sedemikian membolehkan kita menganggarkan hanya nilai pH dengan ketepatan 0.5 unit pada skala pH. Kaedah yang lebih tepat untuk mengukur nilai pH ialah pentitratan asid-bes, yang merangkumi subjenis alkalimetri (pentitratan dengan larutan bes piawai) dan asidimetri (pentitratan dengan larutan asid piawai). Ia menggunakan titran dengan kepekatan yang diketahui, yang, apabila bertindak balas dengan bahan yang diuji, secara berterusan mengubah kepekatan ion hidronium yang terdapat dalam larutan. Penentuan sedemikian boleh dilakukan dalam dua cara: secara visual, apabila menentukan titik akhir, bersama-sama dengan perubahan warna atau dengan penggunaan kaedah instrumental, contohnya potensiometri atau konduktometri. Seperti namanya, penggunaan meter pH juga membolehkan kita menentukan nilai pH bahan tersebut. Instrumen, beroperasi berdasarkan potensiometri, mempunyai sel dalam dua elektrod yang sama. Salah satu daripadanya, dipanggil elektrod penunjuk, harus dimasukkan ke dalam larutan yang diuji. Satu lagi (elektrod perbandingan) diletakkan ke dalam larutan piawai dengan nilai pH yang diketahui. Bahan yang biasa digunakan ialah larutan perak klorida. Kedua-dua elektrod disambungkan dengan voltmeter yang sangat sensitif, yang secara berterusan menukarkan EMF (daya gerak elektrik) kepada hasil tertentu dalam skala pH. Menurut teori Nernst, daya gerak elektrik (EMF) sel, yang terdiri daripada dua elektrod yang sama yang direndam dalam larutan dengan nilai pH yang berbeza, adalah berkadar terus dengan logaritma hasil bagi kedua-dua kepekatan.
Kaedah rumah mengukur nilai pH
Ternyata terdapat banyak penunjuk pH semula jadi, dan nilai pH anggaran boleh diukur dalam persekitaran rumah. Sebagai contoh, infusi yang diperbuat daripada daun teh hitam menjadi lebih cerah apabila dicampur dengan asid, contohnya, jus lemon. Sebaliknya, ia menjadi lebih gelap di bawah pengaruh bes seperti larutan baking soda. Jus kubis merah menukar warnanya daripada ungu kepada merah apabila terkena asid, atau kepada biru apabila dicampur dengan bes.
