Kaedah spektroskopi ialah sekumpulan kaedah di mana isyarat dihasilkan oleh interaksi sinaran elektromagnet atau korpuskular dengan sampel yang diperiksa. Sinaran ini boleh timbul akibat perubahan berkala dalam medan elektromagnet yang berkaitan dengan pemindahan tenaga. Kaedah ini digunakan untuk menentukan kepekatan atau kandungan atom dalam sistem penyerapan atau pemancar tertentu. Apakah jenis spektrofotometri yang ada dan apakah yang melibatkan kaedah ini? Inilah yang anda akan ketahui dari artikel kami.

Sinaran dan peralihan tenaga
Sifat foton yang paling penting, atau radiasi quanta, ialah tenaga. Formula untuk nilai tenaga (E) ialah hasil darab pemalar Planck (h) sebanyak 6.626·10 -34 [J ·s] dan frekuensi sinaran (v) yang dinyatakan dalam Hertz [Hz]. 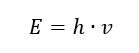 Spektrofotometri menggunakan peralihan tenaga dalam molekul, disebabkan oleh penyerapan atau pelepasan sinaran elektromagnet dalam julat yang berbeza:
Spektrofotometri menggunakan peralihan tenaga dalam molekul, disebabkan oleh penyerapan atau pelepasan sinaran elektromagnet dalam julat yang berbeza:
- ultraungu (UV) 200-380 nm,
- sinaran boleh dilihat (Vis) 380-780 nm,
- dekat inframerah (IR) 0.78-30000 μm.
Konsep asas dan undang-undang spektrofotometri
Titik isosbetik
Ini adalah titik yang sepadan dengan panjang gelombang tertentu yang terhasil daripada persilangan lengkung yang diplotkan dalam sistem panjang gelombang penyerapan, di mana kedua-dua bentuk sebatian dalam larutan (terpisah dan tidak berpisah) mempunyai penyerapan yang sama. Perubahan dalam pH tidak mengubah kedudukan, sebatian mungkin mempunyai banyak titik sedemikian.
Spektrum penyerapan sebatian kimia
Spektrum ialah ukuran jumlah cahaya yang diserap oleh sebatian daripada panjang gelombang cahaya (λ). Jika sinaran elektromagnet (cahaya) berintensiti I 0 jatuh pada sampel, sebahagian daripada sinaran ini akan diserap dan sebahagian lagi akan melalui sampel. Dengan merekodkan keamatan kejadian (I 0 ) dan dipancarkan (I t ) sinaran, kita boleh menentukan jumlah cahaya yang diserap oleh larutan (serapan, A), atau yang telah melaluinya (transmisi, T).
Penyerapan
Kuantiti yang menerangkan fenomena penyerapan ialah penyerapan. Ini ialah ukuran tanpa dimensi keamatan sinaran elektromagnet berbanding bilangan atom bebas. Angka ini diperkenalkan untuk memudahkan pengiraan berkaitan isipadu serapan. Penyerapan ialah interaksi antara sinaran elektromagnet dan jirim – penyerapan sebahagian tenaga oleh jirim. Penyerapan adalah bahan tambahan dan kadangkala dirujuk sebagai ketumpatan optik. Secara simbolik, ia direkodkan sebagai Abs atau A. Secara matematik, ia ialah logaritma perpuluhan nisbah keamatan rasuk kejadian sinaran pada sampel ujian (I 0 ) kepada keamatan rasuk sinaran yang dihantar melalui sampel ujian (I t ). Ia boleh mengambil nilai dari 0 hingga infiniti. Ungkapan matematik yang menerangkan hubungan ini dipanggil undang-undang Beer-Lambert. Penyerapan pada panjang gelombang tertentu bergantung pada pekali penyerapan (ε), ketebalan lapisan penyerap (biasanya 1 cm) dan kepekatan larutan ujian.
Penghantaran
Transmitansi ialah nisbah sinaran yang melalui sampel (I t ) kepada kejadian sinaran pada sampel (I 0 ), yang sama dengan sinaran yang melalui rujukan. Ia paling kerap dinyatakan sebagai peratusan dan boleh berkisar antara 0%hingga 100%. Ia dinyatakan dengan formula: 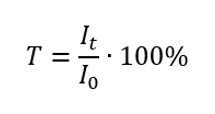 Hubungan antara penyerapan dan penghantaran dinyatakan seperti berikut:
Hubungan antara penyerapan dan penghantaran dinyatakan seperti berikut: 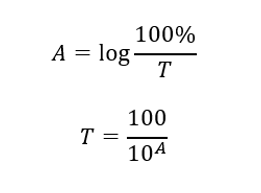
Undang-undang Lambert
Ia mengatakan bahawa penyerapan adalah berkadar dengan ketebalan lapisan penyerap sampel homogen. Ia boleh direkodkan sebagai hasil bagi pekali penyerapan (k) dan ketebalan lapisan sampel yang diukur (l): 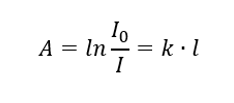

Undang-undang Beer-Lambert
Ia berkenaan dengan penyerapan sinaran oleh larutan dan boleh dirumuskan seperti berikut: jika pekali penyerapan pelarut adalah sifar, maka penyerapan sinaran sinaran monokromatik yang melalui larutan homogen adalah berkadar terus dengan kepekatan (c) larutan. dan kepada ketebalan lapisan penyerap (l). Hukum Beer-Lambert ialah takrifan penyerapan dan boleh ditulis seperti berikut: 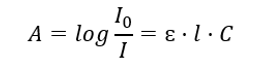 Pekali penyerapan molar (ɛ) ialah nilai ciri bahan dalam pelarut tertentu dan pada panjang gelombang tertentu. Ia berkadar dengan kebarangkalian peralihan antara tahap tenaga molekul dan secara langsung bergantung kepada tenaga foton sinaran. Dalam istilah berangka, ia mewakili penyerapan yang ditunjukkan oleh larutan dengan kepekatan 1 mol/dm 3 , dengan ketebalan lapisan penyerap 1 cm. Mengetahui pekali memungkinkan untuk menentukan kepekatan larutan ujian selepas mengukur magnitud penyerapan. Secara pilihan, jangkaan penyerapan larutan juga boleh dikira daripada pekali dan kepekatan. Formula ini digunakan terutamanya untuk menentukan kepekatan bahan dengan pekali penyerapan molar yang diketahui dan penyerapan diukur secara empirik. Ini boleh dilakukan menggunakan formula atau dengan melukis lengkung penentukuran untuk bahan pada beberapa titik dalam julat kepekatan yang dijangkakan. Undang-undang Beer-Lambert juga boleh dibentangkan sebagai pergantungan kepekatan penyerapan: A = f(C).
Pekali penyerapan molar (ɛ) ialah nilai ciri bahan dalam pelarut tertentu dan pada panjang gelombang tertentu. Ia berkadar dengan kebarangkalian peralihan antara tahap tenaga molekul dan secara langsung bergantung kepada tenaga foton sinaran. Dalam istilah berangka, ia mewakili penyerapan yang ditunjukkan oleh larutan dengan kepekatan 1 mol/dm 3 , dengan ketebalan lapisan penyerap 1 cm. Mengetahui pekali memungkinkan untuk menentukan kepekatan larutan ujian selepas mengukur magnitud penyerapan. Secara pilihan, jangkaan penyerapan larutan juga boleh dikira daripada pekali dan kepekatan. Formula ini digunakan terutamanya untuk menentukan kepekatan bahan dengan pekali penyerapan molar yang diketahui dan penyerapan diukur secara empirik. Ini boleh dilakukan menggunakan formula atau dengan melukis lengkung penentukuran untuk bahan pada beberapa titik dalam julat kepekatan yang dijangkakan. Undang-undang Beer-Lambert juga boleh dibentangkan sebagai pergantungan kepekatan penyerapan: A = f(C).
Hukum aditiviti
Undang-undang Beer-Lambert merujuk kepada kes di mana terdapat satu bahan penyerap dalam larutan. Walau bagaimanapun, jika terdapat lebih banyak bahan dalam larutan berbilang komponen yang menyerap sinaran pada panjang gelombang terpilih, penyerapan larutan ini (A) adalah sama dengan jumlah penyerapan komponen individunya (A 1 , A 2 ,…), iaitu A=A 1 +A 2 +⋯+A n . Perlu diingat dan diingat bahawa penyerapan setiap komponen adalah hasil kepekatannya dan pekali penyerapan molar yang sepadan. Ini adalah undang-undang penyerapan ke-3, digunakan dalam analisis spektrofotometri sistem berbilang komponen.
Penyimpangan daripada undang-undang penyerapan
Prasyarat untuk memenuhi undang-undang penyerapan ialah sinaran yang bertindak pada sistem adalah monokromatik dan keamatannya tidak terlalu tinggi. Sebab-sebab untuk menyimpang daripada undang-undang Beer-Lambert boleh:
- ketidaksempurnaan alat pengukur, mengakibatkan keadaan tidak dipenuhi,
- tindak balas kimia yang berlaku semasa pengukuran, contohnya pempolimeran , hidrolisis, pemeluwapan,
- kekeruhan larutan.
Aplikasi spektrum penyerapan elektron
- Ia membolehkan jenis peralihan elektron ditentukan dengan memeriksa spektrum dalam pelarut dengan kekutuban yang berbeza.
- Perbezaan dalam kedudukan dan keamatan jalur penyerapan bagi bentuk molekul yang berbeza digunakan untuk mengkaji keseimbangan yang wujud di antara mereka dalam larutan ( kajian struktur , keseimbangan tautomerik).
- Digunakan untuk penentuan kompaun berdasarkan undang-undang Beer-Lamber.
- Digunakan sebagai kaedah pengenalan tambahan berdasarkan kedudukan maks λ bahan ujian.
- Digunakan dalam penentuan ketulenan sebatian ujian – mengalihkan kedudukan maksimum penyerapan, membandingkan nisbah nilai penyerapan pada dua titik berbeza dalam spektrum.

Spektroskopi elektron UV-Vis
Dari segi fenomena penyerapan, spektrofotometri UV-Vis adalah teknik yang sangat menarik, membolehkan analisis kualitatif dan kuantitatif bagi banyak bahan. Fenomena penyerapan sinaran digunakan apabila: penyerapan bergantung secara linear pada kepekatan atau apabila penyerapan adalah bahan tambahan, iaitu untuk larutan berbilang komponen ia adalah jumlah penyerapan komponennya. Syarat dipenuhi apabila tiada interaksi antara molekul dalam sistem. Dengan menganalisis spektrum penyerapan UV-Vis yang terhasil daripada laluan sinaran elektromagnet melalui larutan, peralihan elektron valens dari tanah ke keadaan teruja diperhatikan. Fenomena ini mengakibatkan penyerapan sebahagian sinaran pada panjang gelombang tertentu. Penyerapan adalah akibat daripada peralihan elektron ini ke tahap tenaga yang lebih tinggi, tetapi untuk ini berlaku, kuanta sinaran elektromagnet mesti mempunyai tenaga yang mencukupi untuk mengimbangi perbezaan tenaga antara tahap tenaga. Dalam molekul, tenaga sedemikian adalah beberapa elektronvolt, yang sepadan dengan tepat dengan frekuensi UV-Vis.
Chromophores
Sebatian yang menunjukkan penyerapan dalam julat UV-Vis mempunyai kromofor dalam strukturnya, iaitu kumpulan atom yang elektronnya dicirikan oleh tenaga pengujaan yang rendah. Dalam erti kata lain, kromofor ialah bahagian molekul (kumpulan atom) yang bertanggungjawab untuk penyerapan terpilih sinaran dalam julat yang boleh dilihat (180-800 nm) dan dengan itu berlakunya warna. Ini termasuk: cincin aromatik (sextet elektron aromatik), berbilang ikatan (sebahagian daripadanya – ikatan jenis π), kedua-duanya antara atom karbon dan lain-lain, seperti kumpulan karbonil C=O.
Auxochromes
Satu lagi kumpulan atom ialah auksokrom, iaitu substituen yang tidak menunjukkan penyerapan dalam julat UV-Vis, tetapi kehadirannya menyebabkan perubahan dalam spektrum unsur penyerap. Mereka meningkatkan tindakan kromofor, yang sering kita dapat perhatikan dalam bentuk pewarnaan bahan ujian yang jauh lebih sengit daripada sekiranya tiadanya dalam sistem. Di samping itu, kami membahagikan auxochromes kepada bathochromes , cth –NH 2 , -OH, yang mengalihkan penyerapan maksimum ke arah panjang gelombang yang lebih panjang, dan hypsochromes , seperti –CH 3 , -CO, yang menganjak maksimum ke arah panjang gelombang yang lebih pendek.
Spektroskopi Serapan Atom (AAS)
Ini adalah satu lagi teknik menggunakan fenomena penyerapan. Ia digunakan untuk menentukan unsur kimia dalam bentuk sampel dalam mana-mana keadaan (cecair, pepejal, gas) dan pengukuran itu sendiri adalah berdasarkan pemerhatian penyerapan sinaran panjang gelombang tertentu oleh atom logam bebas. Asas teknik ini adalah bahawa atom hanya boleh menyerap sinaran elektromagnet pada panjang gelombang di mana ia juga boleh memancarkannya, dan ini hanya ciri unsur yang diberikan. Dengan tenaga yang lebih tinggi dibekalkan kepada atom, elektron teruja ke tahap yang lebih tinggi dan lebih banyak garis diperhatikan dalam spektrum. Jika tenaga yang dibekalkan sepadan dengan potensi pengionan atom, ion seperti Na + terbentuk. Asas untuk analisis kuantitatif oleh spektrometri penyerapan atom ialah perkadaran penyerapan kepada bilangan atom penyerap dan hukum Beer-Lambert.
