Stoikiometri ialah cabang kimia am yang memperkatakan pengiraan mengenai perjalanan kuantitatif tindak balas kimia. Apabila bekerja di makmal, selalunya perlu mengetahui berapa banyak (jisim, isipadu, molekul) substrat yang perlu kita gunakan agar tindak balas kimia yang kita jalankan berlaku sepenuhnya atau untuk mendapatkan jumlah produk. kami mahu. Kadangkala ia juga perlu untuk mengira lebihan atau kekurangan substrat yang menyebabkan percubaan berjalan berbeza daripada yang dijangkakan. Setiap pengiraan ini mengikuti terus daripada tafsiran kuantitatif persamaan tindak balas kimia dan menggunakan undang-undang pemuliharaan jisim. Jenis persamaan ini dipanggil pengiraan stoikiometrik.

Apa yang kita perlu tahu?
Untuk menggunakan stoikiometri, kita perlu mempunyai pengetahuan dalam beberapa bidang, termasuk: persamaan tindak balas kimia, pekali stoikiometri, jisim mol dan molar serta isipadu molar gas dan hukum Avogadro . Menggunakan pengetahuan tentang stoikiometri tindak balas kimia, banyak masalah pengiraan boleh diselesaikan, seperti:
- analisis unsur,
- pengiraan molar,
- pengiraan jisim,
- pengiraan campuran bukan stoikiometri dengan kemungkinan menentukan bahan pengehad dalam tindak balas,
- hasil tindak balas.
Jisim molar
Oleh kerana jisim atom dan molekul individu yang tidak dapat dibayangkan, unit (u) , menyatakan jisim atom, telah dicipta. Dalam amalan, ini ialah nilai bersamaan dengan 1/12 jisim isotop karbon 12 C. Bahagian bahan ini berkait rapat dengan pemalar Avogadro dan ditentukan sebagai bilangan gram bahan yang mengandungi 6.022·10 23 atom, molekul atau ion. Jisim molar [M] secara berangka sama dengan jisim atom atau molekul , dan unitnya ialah g/mol.
Isipadu molar bahan [Vm]
Ini adalah nilai khusus bahan yang sangat bergantung pada keadaan suhu dan tekanan. Ini ialah isipadu bahan yang diduduki oleh satu mol daripadanya. Di bawah keadaan biasa, nilai malar 22.4 dm 3 diterima pakai.
Hukum komposisi malar dan pemuliharaan jisim
Setiap sebatian kimia, tanpa mengira asal usul dan kaedah mendapatkannya, mempunyai komposisi kualitatif dan kuantitatif yang jelas dan berterusan. Sulfur (IV) oksida, sebagai contoh, sentiasa mengandungi 50%berat sulfur dan sulfur (VI) oksida 40%berat unsur ini. Dalam sistem tertutup, jisim produk yang terhasil adalah sama dengan jisim substrat yang digunakan semasa tindak balas. Undang-undang pemuliharaan jisim dicerminkan dalam keperluan untuk mengimbangi setiap persamaan tindak balas kimia dengan pekali kimia yang sesuai supaya kedua-dua belah persamaan adalah sama dari segi bilangan atom yang hadir. Nisbah stoikiometri mencerminkan nisbah molar bahan tindak balas yang terdapat dalam tindak balas kimia.
Persamaan tindak balas kimia
Semua maklumat yang diperlukan tentang hubungan relatif antara bahan kimia diperolehi daripada persamaan tindak balas kimia mereka. Ia menyediakan beberapa maklumat relatif dan kuantitatif yang penting.
Contoh 1.
Daripada persamaan untuk sintesis ammonia , yang mengikuti tindak balas: ![]() kita boleh melakukan beberapa tafsiran – molekul, molar, jisim molar, isipadu molar dan nombor molekul. a) Dari segi molekul, kita boleh membaca bahawa tiga molekul hidrogen bertindak balas dengan satu molekul nitrogen untuk membentuk dua molekul ammonia. b) Ini juga bermakna tiga mol hidrogen bertindak balas dengan satu mol nitrogen untuk membentuk hasil dua mol ammonia. c) Menggunakan jadual berkala unsur kimia , yang mengandungi jisim molar atom individu, kita juga boleh membuat kesimpulan daripada persamaan bahawa 6 g hidrogen telah bertindak balas sepenuhnya dengan 28 g nitrogen untuk membentuk 34 g ammonia. d) Kemudian, dengan mengandaikan keadaan biasa, kita tahu bahawa satu mol gas menduduki 22.4 dm 3 . Ini membolehkan kita membuat kesimpulan bahawa 67.2 dm 3 hidrogen bertindak balas dengan 22.4 dm 3 nitrogen untuk membentuk 44.8 dm 3 ammonia. e) Satu lagi hubungan berguna ialah hukum Avogadro, yang menyatakan bahawa isipadu yang sama bagi gas yang berbeza mengandungi bilangan zarah yang sama di bawah keadaan tekanan dan suhu yang sama. Mengetahui pemalar Avogadro sebanyak 6.022·10 23 , kita tahu bahawa kita memerlukan 3·6.022·10 23 molekul hidrogen dan 6.022·10 23 molekul nitrogen untuk menjalankan tindak balas kimia yang lengkap untuk sintesis ammonia. Tindak balas menghasilkan 2·6.022·10 23 molekul ammonia.
kita boleh melakukan beberapa tafsiran – molekul, molar, jisim molar, isipadu molar dan nombor molekul. a) Dari segi molekul, kita boleh membaca bahawa tiga molekul hidrogen bertindak balas dengan satu molekul nitrogen untuk membentuk dua molekul ammonia. b) Ini juga bermakna tiga mol hidrogen bertindak balas dengan satu mol nitrogen untuk membentuk hasil dua mol ammonia. c) Menggunakan jadual berkala unsur kimia , yang mengandungi jisim molar atom individu, kita juga boleh membuat kesimpulan daripada persamaan bahawa 6 g hidrogen telah bertindak balas sepenuhnya dengan 28 g nitrogen untuk membentuk 34 g ammonia. d) Kemudian, dengan mengandaikan keadaan biasa, kita tahu bahawa satu mol gas menduduki 22.4 dm 3 . Ini membolehkan kita membuat kesimpulan bahawa 67.2 dm 3 hidrogen bertindak balas dengan 22.4 dm 3 nitrogen untuk membentuk 44.8 dm 3 ammonia. e) Satu lagi hubungan berguna ialah hukum Avogadro, yang menyatakan bahawa isipadu yang sama bagi gas yang berbeza mengandungi bilangan zarah yang sama di bawah keadaan tekanan dan suhu yang sama. Mengetahui pemalar Avogadro sebanyak 6.022·10 23 , kita tahu bahawa kita memerlukan 3·6.022·10 23 molekul hidrogen dan 6.022·10 23 molekul nitrogen untuk menjalankan tindak balas kimia yang lengkap untuk sintesis ammonia. Tindak balas menghasilkan 2·6.022·10 23 molekul ammonia.
Contoh 2.
Tindak balas pembakaran magnesium dalam klorin berlaku mengikut persamaan: ![]() membolehkan kita menghasilkan tafsiran yang serupa dengan contoh sebelumnya. a) Walaupun pada pandangan pertama, persamaan yang dibentangkan membolehkan kita membuat kesimpulan bahawa, untuk mendapatkan satu molekul magnesium klorida , kita mesti membekalkan satu molekul magnesium dan satu molekul klorin sebagai substrat. b) Ini sudah tentu bersamaan dengan bilangan mol yang terdapat dalam sistem, iaitu satu mol magnesium, satu mol klorin, satu mol magnesium klorida. c) Untuk pengiraan jisim, kita tahu bahawa 24 g magnesium bertindak balas dengan 71 g klorin untuk membentuk 95 g magnesium klorida. d) Oleh kerana hanya satu gas, klorin , terlibat dalam tindak balas kimia yang sedang dipertimbangkan, kita juga boleh menulis untuknya bahawa ia menduduki isipadu 22.4 dm 3 . e) Dalam kiraan zarah, setiap komponen adalah sama dengan yang lain dan mengambil nilai 6.022·10 23 .
membolehkan kita menghasilkan tafsiran yang serupa dengan contoh sebelumnya. a) Walaupun pada pandangan pertama, persamaan yang dibentangkan membolehkan kita membuat kesimpulan bahawa, untuk mendapatkan satu molekul magnesium klorida , kita mesti membekalkan satu molekul magnesium dan satu molekul klorin sebagai substrat. b) Ini sudah tentu bersamaan dengan bilangan mol yang terdapat dalam sistem, iaitu satu mol magnesium, satu mol klorin, satu mol magnesium klorida. c) Untuk pengiraan jisim, kita tahu bahawa 24 g magnesium bertindak balas dengan 71 g klorin untuk membentuk 95 g magnesium klorida. d) Oleh kerana hanya satu gas, klorin , terlibat dalam tindak balas kimia yang sedang dipertimbangkan, kita juga boleh menulis untuknya bahawa ia menduduki isipadu 22.4 dm 3 . e) Dalam kiraan zarah, setiap komponen adalah sama dengan yang lain dan mengambil nilai 6.022·10 23 . 
Peratusan hasil tindak balas kimia [ %W]
Pengiraan stoikiometri juga digunakan untuk mengetahui hasil tindak balas, iaitu nisbah jumlah sebenar hasil yang diperoleh kepada jumlah yang diperoleh daripada persamaan tindak balas kimia.
Contoh 1.
Tindak balas pengoksidaan 30 kg sulfur(IV) oksida telah dijalankan dan, dengan kehadiran mangkin platinum, hasil yang diperoleh ialah 34 kg sulfur(VI) oksida. Dengan hasil proses ini? Persamaan tindak balas kimia: ![]() Daripada tindak balas yang direkodkan, kita dapat melihat bahawa dua mol sulfur(IV) oksida menghasilkan jumlah mol sulfur(VI) oksida yang sama. Mengetahui jisim molar bahan tindak balas, kita tahu bahawa secara stoikiometrik, dengan mengandaikan hasil 100%, 128 g SO 2 menghasilkan 160g SO 3 . Dengan pengetahuan ini, kita boleh menyusun nisbah: 0.128 kg SO 2 – 0.160 kg SO 3 30 kg SO 2 – x kg SO 3 Dari sini kita akan mengetahui jumlah sulfur(VI) oksida yang akan dihasilkan pada 100 peratus hasil.
Daripada tindak balas yang direkodkan, kita dapat melihat bahawa dua mol sulfur(IV) oksida menghasilkan jumlah mol sulfur(VI) oksida yang sama. Mengetahui jisim molar bahan tindak balas, kita tahu bahawa secara stoikiometrik, dengan mengandaikan hasil 100%, 128 g SO 2 menghasilkan 160g SO 3 . Dengan pengetahuan ini, kita boleh menyusun nisbah: 0.128 kg SO 2 – 0.160 kg SO 3 30 kg SO 2 – x kg SO 3 Dari sini kita akan mengetahui jumlah sulfur(VI) oksida yang akan dihasilkan pada 100 peratus hasil. 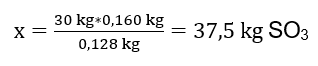 Mengetahui jumlah teori dan sebenar SO 3 , kita boleh mengira hasil di mana tindak balas berlaku. 37.5 kg SO 3 – 100%hasil 34 kg SO 3 – x%hasil
Mengetahui jumlah teori dan sebenar SO 3 , kita boleh mengira hasil di mana tindak balas berlaku. 37.5 kg SO 3 – 100%hasil 34 kg SO 3 – x%hasil 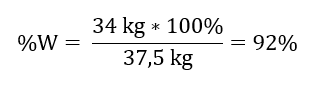 Pengoksidaan sulfur(IV) oksida kepada sulfur(VI) oksida menggunakan mangkin platinum berlaku dengan hasil 92%.
Pengoksidaan sulfur(IV) oksida kepada sulfur(VI) oksida menggunakan mangkin platinum berlaku dengan hasil 92%.
Formula molekul dan unsur
Satu lagi aplikasi pengiraan stoikiometri adalah untuk menentukan formula sebatian kimia mudah. Formula molekul sebatian kimia adalah sama dengan, atau gandaan integer, formula empirik. Jika kita tahu bahawa formula am sebatian kimia ialah N x O y , nilai indeks stoikiometri boleh dikira dengan membahagikan jisim setiap atom dengan jisim atomnya. Jika berat molekul sebatian kimia tidak diketahui, tetapi hanya komposisi peratusannya, hanya formula unsur boleh diberikan. Ia boleh menjadi perwakilan sebenar formula molekul atau hanya menentukan nisbah unsur individu.
Contoh 1.
Berat molekul sebatian kimia ialah 92 u dan ia terdiri daripada 30.43%nitrogen dan 69.57%oksigen. Apakah formula molekul bagi sebatian kimia itu? Oleh kerana jumlah molekul yang terdapat dalam sebatian adalah 100%kita boleh mengandaikan bahawa: 92 u – 100%Ini membolehkan kita mengira kandungan unsur individu: 92 u – 100%xu nitrogen – 30.43%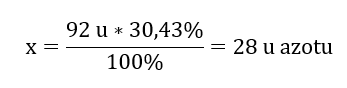 Oleh itu kita tahu bahawa jisim setiap atom oksigen ialah: 92 u – 28 u = 64 u Mengetahui jisim individu unsur, kita boleh menentukan indeks stoikiometri:
Oleh itu kita tahu bahawa jisim setiap atom oksigen ialah: 92 u – 28 u = 64 u Mengetahui jisim individu unsur, kita boleh menentukan indeks stoikiometri: 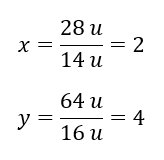 Formula molekul bagi sebatian kimia ini ialah N 2 O 4 .
Formula molekul bagi sebatian kimia ini ialah N 2 O 4 .
Contoh 2.
Terdapat dua unsur dalam sebatian kimia – oksigen pada 60 %dan 40 %sulfur. Apakah formula unsurnya? Formula am ialah S x O y , di mana x ialah 40 %dan y ialah 60%. Mengetahui jisim molar unsur-unsur individu, ini boleh diwakili seperti berikut: 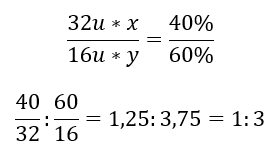 Ini bermakna bahawa dalam sebatian kimia yang diberikan, terdapat tiga atom oksigen untuk setiap satu atom sulfur. Formula unsurnya ialah SO 3 .
Ini bermakna bahawa dalam sebatian kimia yang diberikan, terdapat tiga atom oksigen untuk setiap satu atom sulfur. Formula unsurnya ialah SO 3 . 
Lebihan dan menghadkan substrat
Dalam kes tindak balas di mana bahan tindak balas hadir dalam nisbah yang berbeza daripada stoikiometri yang sepadan, salah satu bahan tindak balas akan bertindak balas sepenuhnya dan tindak balas akan berhenti. Ia kemudiannya hadir dalam bentuk bahan tindak balas pengehad, manakala bahan tindak balas kedua akan berada dalam sistem secara berlebihan dan juga akan tetap wujud dalam sistem dalam bentuk utamanya apabila tindak balas selesai.
Contoh 1.
Di dalam makmal, 40 cm 3 larutan aluminium sulfat 0.25 M telah bertindak balas dengan 50 cm 3 larutan barium klorida 0.5 M. Berapa gram mendakan akan terbentuk? Persamaan tindak balas kimia: ![]() Langkah pertama untuk mengetahui perjalanan sebenar tindak balas adalah untuk menentukan bilangan mol sebenar bahan yang terlibat dalam tindak balas. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0.25 · 0.04 dm 3 = 0.010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0.5 · 0.05 dm 3 = 0.025 mol Langkah kedua ialah untuk menentukan substrat defisit berdasarkan stoikiometri tindak balas – ini akan menentukan jumlah mendakan yang terbentuk. 1mol Al 2 (SO 4 ) 3 – 3mol BaCl 2 0.010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
Langkah pertama untuk mengetahui perjalanan sebenar tindak balas adalah untuk menentukan bilangan mol sebenar bahan yang terlibat dalam tindak balas. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0.25 · 0.04 dm 3 = 0.010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0.5 · 0.05 dm 3 = 0.025 mol Langkah kedua ialah untuk menentukan substrat defisit berdasarkan stoikiometri tindak balas – ini akan menentukan jumlah mendakan yang terbentuk. 1mol Al 2 (SO 4 ) 3 – 3mol BaCl 2 0.010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 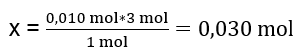 Untuk menjalankan tindak balas sepenuhnya, mempunyai 0.010mol Al 2 (SO 4 ) 3 , adalah perlu untuk menambah 0.030mol BaCl 2 kepada sistem. Walau bagaimanapun, hanya 0.025mol barium klorida bertindak balas, yang bermaksud ia berada dalam defisit dan akan mengehadkan tindak balas. Oleh itu, jumlah mendakan yang terbentuk dalam tindak balas hendaklah dikira daripada jumlah substrat ini. Bilangan mol barium klorida yang digunakan mengikut stoikiometri tindak balas adalah sama dengan bilangan mol mendakan yang terbentuk, oleh itu: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 Mengetahui bilangan mol barium sulfat, kita boleh mengira jisimnya: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0.025mol · 233.393 g/mol = 5.835g Tindak balas dan jumlah substrat yang diberikan dalam tugas menghasilkan 5.835g mendakan barium sulfat.
Untuk menjalankan tindak balas sepenuhnya, mempunyai 0.010mol Al 2 (SO 4 ) 3 , adalah perlu untuk menambah 0.030mol BaCl 2 kepada sistem. Walau bagaimanapun, hanya 0.025mol barium klorida bertindak balas, yang bermaksud ia berada dalam defisit dan akan mengehadkan tindak balas. Oleh itu, jumlah mendakan yang terbentuk dalam tindak balas hendaklah dikira daripada jumlah substrat ini. Bilangan mol barium klorida yang digunakan mengikut stoikiometri tindak balas adalah sama dengan bilangan mol mendakan yang terbentuk, oleh itu: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 Mengetahui bilangan mol barium sulfat, kita boleh mengira jisimnya: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0.025mol · 233.393 g/mol = 5.835g Tindak balas dan jumlah substrat yang diberikan dalam tugas menghasilkan 5.835g mendakan barium sulfat.
