Kalsium Fluorida (fluorspar) sudah pasti salah satu sebatian bukan organik yang paling terkenal dan paling berharga. Oleh kerana sifat khususnya, ia digunakan untuk pelbagai tujuan baik di rumah dan kilang perindustrian. Apakah ciri-ciri kalsium fluorida dan di mana ia digunakan? Mari kita semak perkara itu.

Apakah fluorida?
Sebatian seperti kalsium fluorida atau kalium fluorida tergolong dalam kumpulan yang secara kolektif dirujuk sebagai fluorida. Ia adalah garam asid hidrofluorik bukan organik yang mengandungi fluorin. Rata-rata pengguna hanya akan mengaitkan fluorida dengan rawatan fluoridasi yang diberikan secara profilaktik di sekolah dan tadika. Sememangnya, sebatian telah menjadi paling popular kerana kandungan fluorin sebagai ramuan ubat gigi, ubat kumur dan persediaan pengukuhan enamel gigi.
Kalsium fluorida: pengeluaran dan sifat
Apakah kalsium fluorida? Formula molekul sebatian ialah CaF 2 dan nama sistematiknya ialah: kalsium difluorida. Bahan itu datang sebagai kristal kecil, berkilat dan berkaca dan diperoleh melalui tindak balas asid hidrofluorik binari dengan kalsium karbonat . CaF 2 berlaku secara semula jadi sebagai mineral biasa yang dipanggil fluorit. Kristal fluorit mempunyai warna yang berbeza-beza, dari merah jambu hingga hijau dan biru. Dan apakah sifat fizikal dan kimia kalsium fluorit? Sebatian ini mempunyai keterlarutan yang rendah dalam air. Ia hampir tidak larut dalam asid dan merupakan pengalir elektrik yang lemah. Berat molekul kalsium fluorida ialah 78.08 g/mol dan ketumpatan ialah 3.18 g/cm³ (20 °C). Hablur CaF 2 mula cair pada suhu 1418 ºC dan mendidih pada 2500 ºC . Bahan tersebut menyebabkan kakisan bahan yang berbeza dan bertindak balas dengan asid sulfurik (VI). Kalsium fluorida terurai kepada kation kalsium dan anion fluorin.
Penggunaan kalsium fluorida
Kalsium fluorida digunakan secara meluas dalam industri dan seterusnya. Sebatian kimia ini kebanyakannya sesuai untuk pengeluaran hidrogen fluorida, yang digunakan contohnya dalam pengelasan kaca dan pengeluaran yis. CaF 2 berguna sebagai reagen dalam makmal kimia . Ia juga merupakan bahan mentah berharga yang digunakan dalam pengeluaran:
- penapis dan cermin mata optik,
- salutan anti-pantulan,
- kosmetik,
- baja nitrogen (kalsium) yang digunakan dalam pertanian,
- persediaan pergigian dan varnis.
Fluorin dan sebatiannya kalsium fluorida dan natrium fluorida mempunyai pelbagai kegunaan dalam profilaksis karies. Ia digunakan untuk menghasilkan gel, pencuci mulut dan pes yang menguatkan enamel gigi dan melindungi daripada asid. Bahan-bahan tersebut digunakan dalam stomatologi dan perubatan estetik. 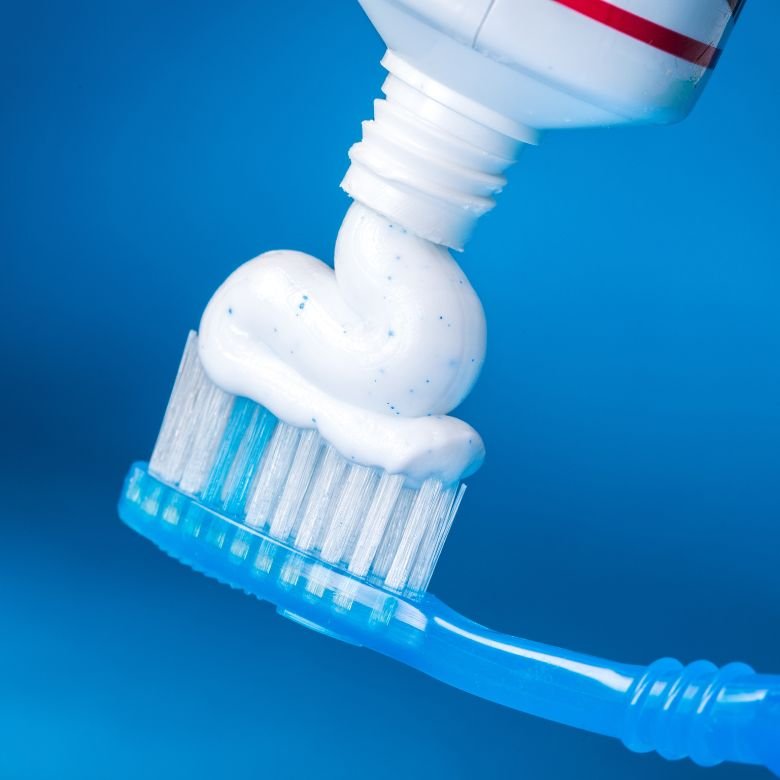
Kalsium fluorida – kemudaratan
Adakah kalsium fluorida berbahaya? Sama seperti bahan kimia lain, kalsium fluorida boleh menyebabkan beberapa penyakit yang tidak menyenangkan pada sistem pernafasan dan pencernaan, jika disalahgunakan. Di bawah keadaan makmal, penyedutan asap CaF 2 menyebabkan lecuran organ dalaman dan juga membawa kepada edema pulmonari. Apakah bahaya hasil saya daripada pencernaan kalsium fluorida? Kristal menyebabkan keracunan meresap yang gejalanya termasuk sakit perut, cirit-birit dan kesemutan pada anggota badan. Sentuhan kalsium fluorida dengan mukosa mata menyebabkan kemerahan dan pembakaran. Walau bagaimanapun, ambil perhatian bahawa dos kecil CaF 2 tidak mempunyai kesan sampingan, jika digunakan seperti yang disyorkan oleh pengilang.
Sebilangan kecil titbits pada kalsium fluorida
Fluorit yang terdapat di alam mempunyai beberapa nama. Pelombong memanggilnya spar atau river spar. Kalsium fluorida digunakan dalam penghasilan makanan tambahan yang meningkatkan fungsi semua organ dalam badan, terutamanya otot dan tulang. Serbuk yang mengandungi CaF 2 digunakan dalam rawatan untuk merangsang sistem imun dan meningkatkan kualiti keseimbangan air-mineral seluruh badan.
- https://chemicalsafety.ilo.org/dyn/icsc/showcard.display?p_lang=pl&p_card_id=1323&p_version=2
- https://pubchem.ncbi.nlm.nih.gov/compound/Calcium-Fluoride
- https://www.britannica.com/science/calcium-fluoride
