Qua chemische structuur behoren alkanen tot de groep koolwaterstoffen. Deze verbindingen bevatten slechts twee soorten atomen: koolstof en waterstof. Ze zijn samengesteld uit het basiskoolstofraamwerk gekoppeld aan waterstofatomen. Alkanen hebben slechts enkele bindingen, daarom worden ze verzadigde koolwaterstoffen genoemd.

Homologe serie
Gerangschikt door de groeiende hoeveelheid waterstofatomen in hun structuur, vormen alkaanvertegenwoordigers een homologe reeks. Het begint met methaan, dat één koolstofatoom bevat, en eindigt met decaan met negen koolstofatomen. De namen van alkanen zijn afkomstig van de hoeveelheid koolstofatomen die in de structuur aanwezig zijn en worden gedefinieerd met Griekse of Latijnse cijfers en het karakteristieke einde -aan, zoals bij heptaan, nonaan, enz. De algemene formule voor alkanen is de volgende: , waarbij ‘n’ staat voor het aantal koolstofatomen (C) dat aanwezig is in de keten en ‘H’ staat voor de waterstofatomen.
| Het aantal koolstofatomen aanwezig in de keten | Alkaan formule | Alkaan naam |
| 1 | CH 4 | methaan |
| 2 | C 2 H 6 | ethaan |
| 3 | C 3 H 8 | Propaan |
| 4 | C 4 H 10 | Butaan |
| 5 | C 5 H 12 | pentaan |
| 6 | C 6 H 14 | Hexaan |
| 7 | C 7 H 16 | Heptaan |
| 8 | C 8 H 18 | Octaan |
| 9 | C 9 H 20 | Nonaan |
| 10 | C 10 H 22 | Decaan |
Soorten verzadigde koolwaterstoffen
Qua ketenstructuur onderscheiden we de volgende soorten alkanen:
-
Lineaire (paraffine) alkanen
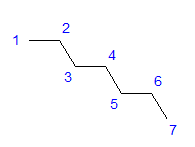 Fig. 1 Structuurformule van heptaan Alle koolstofatomen vertonen de sp 3 hybridisatie. Vanwege een tetragonale hoek tussen de bindingen is een zigzagvormige rangschikking van koolstofatomen vereist. Moleculen kunnen verschillende arrangementen aannemen, aangezien vrije rotatie mogelijk is rond een enkele binding tussen koolstofatomen. Hoe hoger het koolstofgetal in de structuur, hoe gevarieerder de kettingvormen kunnen zijn.
Fig. 1 Structuurformule van heptaan Alle koolstofatomen vertonen de sp 3 hybridisatie. Vanwege een tetragonale hoek tussen de bindingen is een zigzagvormige rangschikking van koolstofatomen vereist. Moleculen kunnen verschillende arrangementen aannemen, aangezien vrije rotatie mogelijk is rond een enkele binding tussen koolstofatomen. Hoe hoger het koolstofgetal in de structuur, hoe gevarieerder de kettingvormen kunnen zijn.
-
Isoalkanen: vertakte verzadigde koolwaterstoffen
De vorming van vertakte koolwaterstoffen is het effect van koppeling tussen een koolstofatoom en meer dan twee andere koolstofatomen. Op het punt van zo’n schakel wordt een vertakking gevormd. Vertakte koolwaterstoffen zijn lineaire koolwaterstofisomeren. 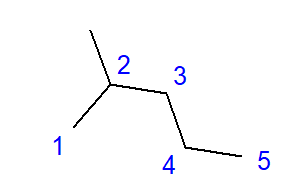 Fig. 2 Structuurformule voor 2-methylpentaan De formule voor 2-methylpentaan weergegeven in Fig. 2 heeft in totaal zes koolstofatomen en is een hexaanisomeer. De naam ‘2-methylpentaan’ betekent dat de pentaanketen een gekoppelde methylgroep heeft op de positie van het tweede koolstofatoom. Het aantal mogelijke structurele isomeren groeit samen met het groeiende aantal koolstofatomen. Om een voorbeeld te geven, hexaan kan een structuur hebben van 5 verschillende isomeren, octaan heeft 18 van dergelijke mogelijkheden en hexaan maar liefst 75.
Fig. 2 Structuurformule voor 2-methylpentaan De formule voor 2-methylpentaan weergegeven in Fig. 2 heeft in totaal zes koolstofatomen en is een hexaanisomeer. De naam ‘2-methylpentaan’ betekent dat de pentaanketen een gekoppelde methylgroep heeft op de positie van het tweede koolstofatoom. Het aantal mogelijke structurele isomeren groeit samen met het groeiende aantal koolstofatomen. Om een voorbeeld te geven, hexaan kan een structuur hebben van 5 verschillende isomeren, octaan heeft 18 van dergelijke mogelijkheden en hexaan maar liefst 75.
-
Cyclische koolwaterstoffen: cycloalkanen, alicyclische koolwaterstoffen
Het is mogelijk om de kettingstructuur te sluiten terwijl ringen worden gevormd die zijn samengesteld uit zich herhalende –CH 2 – elementen. De namen zijn gebaseerd op de naam van het alkaan met het voorvoegsel ‘cyclo-‘, zoals cyclobutaan of cycloheptaan. Om het gemakkelijker te maken, kunnen ze worden gepresenteerd als regelmatige polygonen. 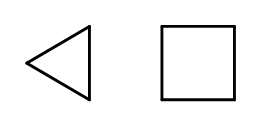 Afb. 3 Van links: cyclopropaan, cyclobutaan Er zijn ook vervangende ringen waarvan de namen de substituenten omvatten. In dit geval zijn de aantallen koolstofatomen zo ontworpen dat de locatie van substituenten mogelijk laag is.
Afb. 3 Van links: cyclopropaan, cyclobutaan Er zijn ook vervangende ringen waarvan de namen de substituenten omvatten. In dit geval zijn de aantallen koolstofatomen zo ontworpen dat de locatie van substituenten mogelijk laag is.
Belangrijkste vertegenwoordigers
Methaan is een verbinding met de molecuulformule CH 4 , waarmee de homologe reeks alkanen begint. Koolstof is vierwaardig, dus het heeft vier CH-bindingen. Bij kamertemperatuur is het een geurloos en kleurloos gas. Omdat het koolstofatoom de sp3 – hybridisatie vertoont, is het gestructureerd als een tetraëder en vormen de geproduceerde orbitalen equivalente bindingen samen met vier waterstofatomen. Ethaan is het volgende alkaan in de reeks, waarvan de molecuulformule C 2 H 6 is. Als we naar de semi-structuurformule H 3 C-CH 3 kijken, zien we dat elk koolstofatoom is verbonden met drie waterstofatomen. Net als methaan en andere lagere koolwaterstoffen is het een kleurloos en reukloos gas. De CH-bindingen zijn frontale sigma sp-s-bindingen, terwijl een enkele binding tussen koolstofatomen een frontale sigma sp-sp-binding is.
De synthese van alkanen
- De hydrogenering van alkenen of alkynen

- De hydrolyse van Grignard-verbindingen
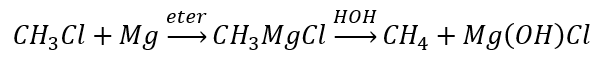
- De reductie van alkylhalogeniden
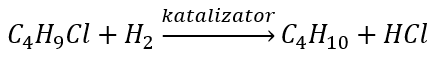
- Wurtz-reactie
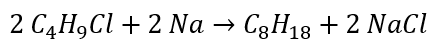
De reductie van aldehyden en ketonen
- Clemmensen-reductie
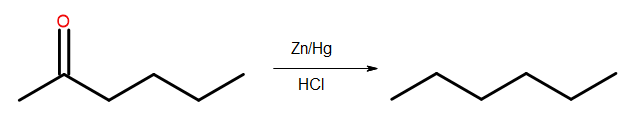 Fig. 4 Schema van Clemmensen-reductie
Fig. 4 Schema van Clemmensen-reductie
- Wolff-Kishner-reactie
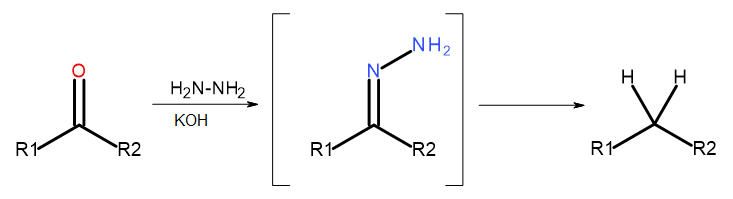 Afb. 5 Schema van Wolff-Kishner
Afb. 5 Schema van Wolff-Kishner
De fysisch-chemische eigenschappen van alkanen
Alkanen met een korte keten van C 1 tot C 4 bij kamertemperatuur zijn gassen. Andere homologen (beginnend met pentaan) zijn vloeistoffen met een groeiend kookpunt. De in de structuur aanwezige takken resulteren in een lager kookpunt van isomeren. De afhankelijkheid van het toevoegen van een andere -CH 2 – groep in de structuur verhoogt het kookpunt ongeveer 20-30 o C hoger, samen met het vergroten van de lengte van de koolstofketen. De aggregatietoestand van alkanen vanaf octadecaan is solide met smeltpunten vanaf 28 o C voor n-octadecaan. Vaste koolwaterstoffen omvatten paraffine, terwijl hogere vloeibare koolwaterstoffen paraffineolie omvatten. Vanwege hun hydrofobe aard vermengen alkaanmoleculen zich niet met water, worden ze niet bevochtigd door water en lossen ze niet op in water. Door hun affiniteit met niet-polaire eigenschappen lossen ze echter gemakkelijk op in zichzelf en in vergelijkbare niet-polaire, medium- en laagpolaire organische oplosmiddelen. De oplosbaarheid van alkanen in twee populaire alcoholische oplosmiddelen (methanol en ethanol) is relatief goed. In methanol lossen alkanen alleen goed op tot een bepaalde concentratie. De overmaat van die concentratie zorgt ervoor dat de fasen scheiden. In ethanol lossen lagere alkanen heel gemakkelijk op, terwijl het iets moeilijker is om hogere alkanen op te lossen. Hogere koolwaterstoffen zijn brandbare stoffen. Gasvormige koolwaterstoffen evenals paren vloeibare koolwaterstoffen vormen mengsels met explosiegevaar bij vermenging met lucht. De reactiviteit van alkanen is relatief laag vanwege het ontbreken van potentieel reactieve functionele groepen. De bindingen tussen koolstofatomen (CC) en die tussen de koolstof- en zuurstofatomen (CH) zijn zeer goed bestand tegen splitsing. De energieën van deze bindingen zijn respectievelijk 88 kcal/mol en 104 kcal/mol. Ze kunnen alleen onder bepaalde omstandigheden abrupt reageren.
De reacties van alkanen
- Volledige verbranding – met uitstoot van kooldioxide
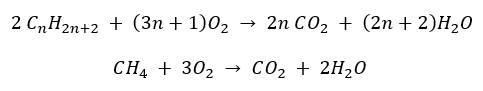
- Halfverbranding – met beperkte zuurstof en de uitstoot van koolmonoxide
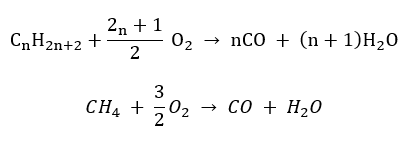
- Onvolledige verbranding – roet wordt gevormd met een zeer beperkte hoeveelheid zuurstof
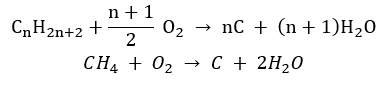
- De substitutiereactie (radicale halogenering, geïllustreerd door de reactie van methaan met chloor met deelname van licht)
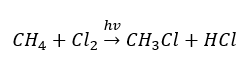
- Pyrolyse is de ontleding van alkanen tot kleinere moleculen bij een zeer hoge temperatuur. Afhankelijk van het proces kan kraken, hydrokraken of isomerisatie optreden.
- Nitratie met behulp van salpeter(V)zuur en vorming van een mengsel van producten: isomeren met de –NO 2 substituent op verschillende plaatsen.
- Tweetraps sulfonering, waarbij mersols tussenproducten zijn en mersolans het eindproduct.
