Alkenen zijn onverzadigde koolwaterstoffen, die net als alkanen een homologe reeks vormen. In tegenstelling tot alkanen hebben alkenen echter één meervoudige binding - een dubbele binding - tussen koolstofatomen. De overigen zijn enkele bindingen, maar het voorkomen van zelfs maar één meervoudige binding in een molecuul maakt de koolwaterstof tot een onverzadigde verbinding.

De structuur van alkenen
De CC-binding tussen atomen in verzadigde koolwaterstoffen zorgt ervoor dat elk van hen een sp3 – hybridisatie heeft. In alkenen, die C=C-bindingen hebben, vindt een sp 2 -hybridisatie plaats. Deze eigenschap zorgt ervoor dat de structuur van verbindingen met dubbele bindingen een trigonale vorm is. De 3 sigma-bindingen bevinden zich in hetzelfde vlak en zijn gericht naar de hoeken van de gelijkzijdige driehoek, waarvan het middelpunt het koolstofatoom is. Daarentegen zijn pi-bindingen het resultaat van de overlapping van een niet-hybride p-orbitaal in een richting loodrecht op de driehoek, die is gevormd uit hybride orbitalen en de orbitalen met vergelijkbare symmetrie van het naburige atoom. De eenvoudigste constructie van de groep, en de eerste verbinding in de alkeen homologe reeks, is etheen. Methaan, een verbinding die de eerste van de alkanen is, kon geen meervoudige binding vormen.
Een voorbeeld van de structuur van het alkeen
Laten we de eenvoudigste verbinding van de groep, etheen, nemen en de structuur ervan onderzoeken. We weten dat de koolstofatomen in het molecuul etheen een sp 2 hybridisatie hebben, dus het molecuul is plat. De hoeken tussen bindingen in deze lay-out zijn 120 o . De vier bindingen tussen de koolstof- en waterstofatomen die in de structuur CH aanwezig zijn, zijn sigma δ SP-s- bindingen met een frontale overlap. Er worden ook homonucleaire bindingen gevormd tussen de koolstofatomen. De ene is CC δ sp-sp en de andere is CC π pp , die is gevormd uit niet-hybride p-orbitalen.
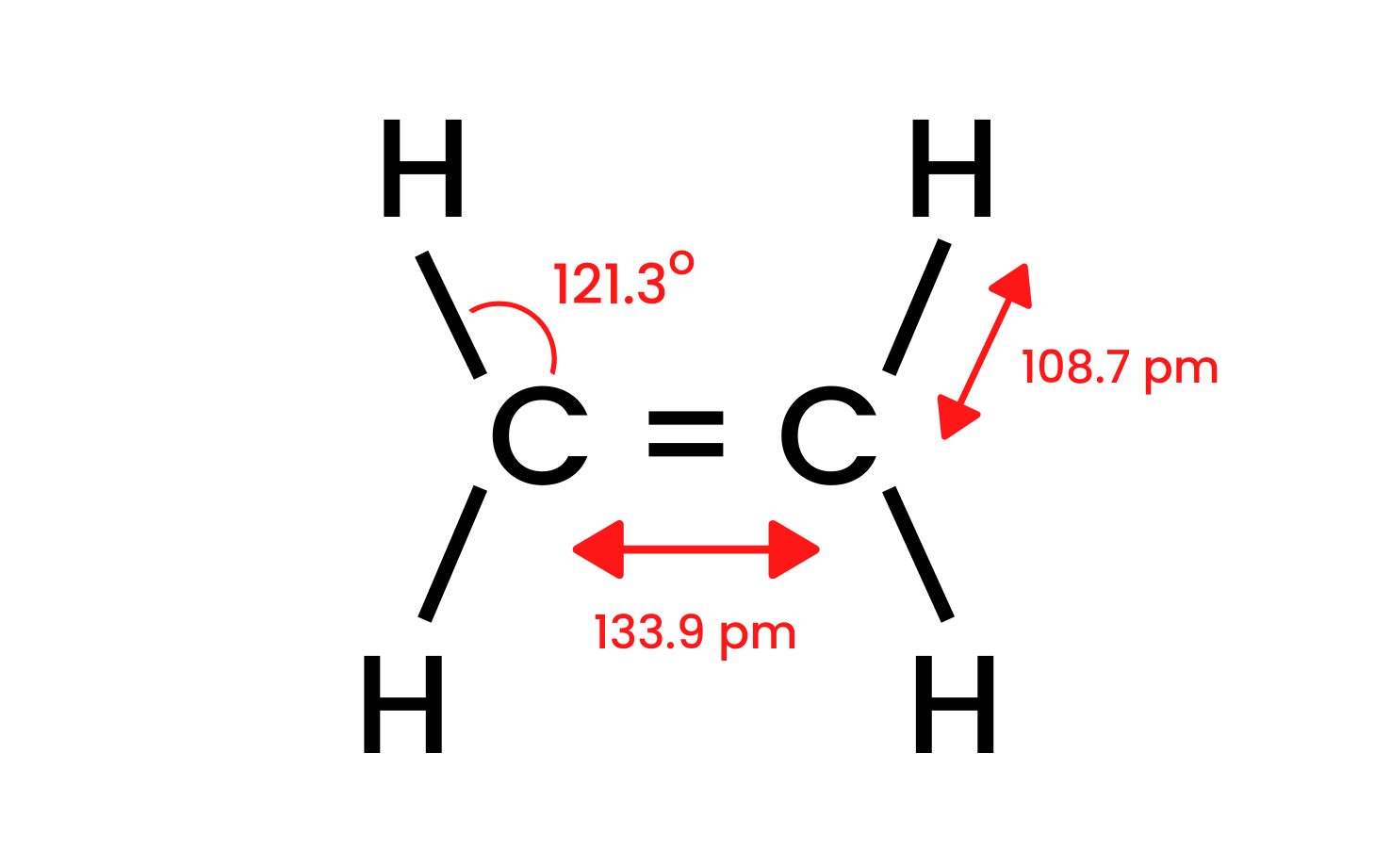
Figuur 1. De structuur van etheen
Alkeen homologe reeks
Een homologe reeks is een groep chemische verbindingen die een zeer vergelijkbare chemische structuur en eigenschappen hebben. Dergelijke stoffen kunnen ook worden geschreven met een gemeenschappelijke molecuulformule. De algemene formule voor alkenen kan worden geschreven als C n H 2n . Structureel ziet het er zo uit:
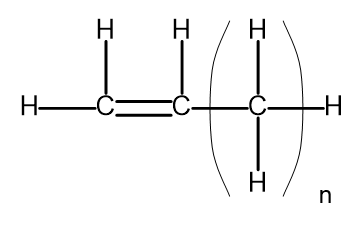
Figuur 2. Algemene structuurformule voor alkenen
| Aantal koolstofatomen in de keten | Alkaan formule | Alkaan naam | Alkeen formule | Alkeen naam |
| 2 | C 2 H 6 | ethaan | C 2 H 4 | etheen |
| 3 | C 3 H 8 | Propaan | C 3 H 6 | Propeen |
| 4 | C 4 H 10 | Butaan | C 4 H 8 | Buteen |
| 5 | C 5 H 12 | pentaan | C 5 H 10 | Penteen |
| 6 | C 6 H 14 | Hexaan | C 6 H 12 | Hexeen |
| 7 | C 7 H 16 | Heptaan | C 7 H 14 | Hepteen |
| 8 | C 8 H 18 | Octaan | C 8 H 16 | Octeen |
| 9 | C 9 H 20 | Nonaan | C 9 H 18 | Geen |
| 10 | C 10 H 22 | Decaan | C 10 H 20 | verval |
De verbindingen van buteen tot deceen kunnen vertakkingen hebben op gelijke plaatsen van koolstofatomen, dus ze kunnen ook but-1-een, hept-1-een of dec-1-een worden genoemd. Dit betekent dat de onverzadigde binding aanwezig is tussen de koolstofatomen die de keten beginnen. Het fenomeen van de verschillende plaatsingsmogelijkheden van de onverzadigde meervoudige binding wordt positionele isomerie genoemd. Een verbinding met de molecuulformule C 7 H 14 heeft bijvoorbeeld verschillende mogelijke positionele isomeren. De dubbele binding in zijn structuur kan zich bijvoorbeeld bevinden op de koolstofatomen nummer één en drie, zoals weergegeven in figuur 3.
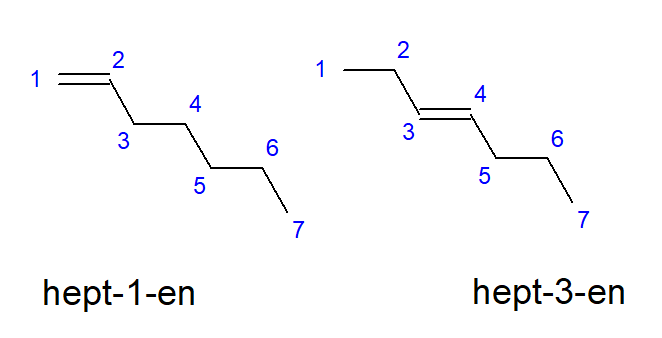
Afbeelding 3. Structuurformules van hept-1-een (1-hepteen) en hept-3-een (3-hepteen)
Structuur van alkenen – samenvatting
Elk alkeen heeft een dubbele pi-binding (π) waarbij platte structuren ontstaan. Koolstofatomen hebben een sp 2 hybridisatie, gekenmerkt door een trigonale vorm. Op verzadigde locaties kunnen de –CH 2 – methyleengroepen ruimtelijk geëxpandeerde rechte en vertakte ketens vormen. Rotatie vindt alleen plaats rond de enkele bindingen en niet in het geval van de C=C-binding. De fysische en chemische basiseigenschappen van de groep van alkenen Alkenen hebben hydrofobe eigenschappen en zijn daarom apolair van aard. Ze gaan reacties aan met water. Vanwege hun affiniteit lossen ze goed op in niet-polaire oplosmiddelen zoals alkanen. Het smeltpunt, het kookpunt en de dichtheid van de alkenen nemen toe naarmate het aantal koolstofatomen in het molecuul toeneemt. Hun activiteit is de grootste in alkenen met een korte keten.
Het verkrijgen van alkenen
Er zijn verschillende manieren om alkenen te verkrijgen. Elk van deze manieren is gebaseerd op de eliminatie van twee substituenten bij een enkele binding, zoals weergegeven in het diagram:
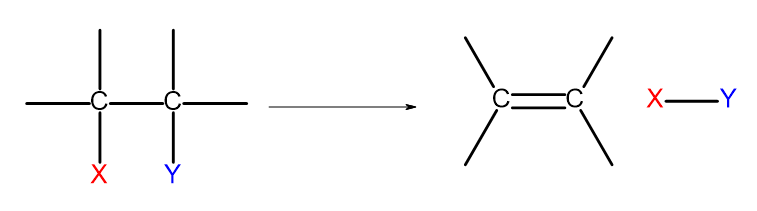
Figuur 4. Het diagram van het eliminatieproces dat resulteert in de vorming van een alkeen
Het verkrijgen van etheen
1. Dehydrogenering van een alkaan 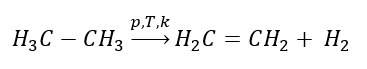 2. Uitdroging van een alcohol
2. Uitdroging van een alcohol 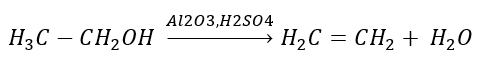 3. De reactie van een halogeenalkaan met een sterke base
3. De reactie van een halogeenalkaan met een sterke base 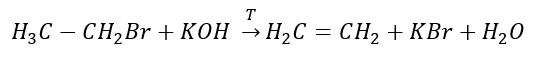 4. De reactie van een dihalogeenalkaan met zinkstof
4. De reactie van een dihalogeenalkaan met zinkstof 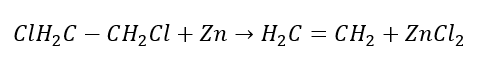 5. Hydrogenering van een alkyn
5. Hydrogenering van een alkyn 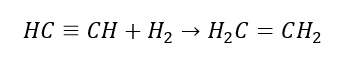
Chemische reacties van alkenen
Een deeltje-specifiek fragment, dat tegelijkertijd zijn eigenschappen en affiliatie definieert, wordt een functionele groep genoemd. Voor alkenen is deze groep een dubbele binding (C=C). De pi-binding (π) die het bevat, is erg vatbaar voor breuk. Vergeleken met elektronen van de sigma-bindingen, zijn elektronen die de pi-orbitaal bezetten verder weg van de koolstofatomen en zijn daarom minder daarmee geassocieerd. Dit resulteert in hun grotere mobiliteit en grotere beschikbaarheid voor naderende reagentia, wat resulteert in een hoge chemische reactiviteit van de binding. Er zijn verschillende soorten reacties volgens welke de alkenen worden getransformeerd. Dit zijn: elektrofiele additie, vrije radicalen additie, oxidatie en reductie, polymerisatie en allylische substitutie.
Elektrofiele toevoeging
Vanwege de aard van elektronen van de pi-binding hebben de middelen die ze aanvallen een elektropositief karakter. Dergelijke moleculen zijn elektrofiele reagentia die een hoge affiniteit hebben voor elektronen. In de meeste gevallen is deze factor een proton van zure oorsprong, een elektronenkloof of een molecuul dat gemakkelijk gepolariseerd is doordat het zich dicht bij pi-elektronen bevindt. De toevoeging, dwz de verbindingsreactie, volgt het ionenmechanisme. Dit is een tweestapsmechanisme waarbij een aanvankelijk naderend elektrofiel reagens de elektronen van de pi-binding vangt met de vorming van een enkele binding en de vorming van een voorbijgaande carbokation. Dit zeer reactieve molecuul valt snel andere reagentia aan die het vermogen hebben om elektronen te mutualiseren. Voorbeelden van dergelijke reacties zijn toevoegingen van chloor of broom aan een alkeen. Waterstof kan ook als toevoeging worden toegevoegd (hydrogenisering), maar is niet elektrofiel.
Additiereacties met vrije radicalen
Veel reacties van alkenen vertonen niet-naleving van de regel van Markovnikov. Hun mechanisme is gericht op de reactie van elektronen van de pi-binding op vrije radicalen, waarbij een koolstof-aanvallende deeltjesbinding wordt geproduceerd. Als resultaat van deze veranderingen wordt een nieuwe vrije radicaal verkregen, die een ongepaard elektron heeft aan het naburige koolstofatoom.
Allylische vervanging
Naast de reactie waarbij de dubbele binding betrokken is, kunnen alkenen ook reageren op een manier die vergelijkbaar is met die van alkanen in naburige alkylgroepen. Een voorbeeld van zo’n reactie is de vervanging van een waterstofatoom door halogeen aan het atoom naast het koolstofatoom dat de dubbele binding vormt. Deze reactie heeft geen invloed op het onverzadigde deel van de structuur.
