Onder de organische chemische verbindingen die worden opgenomen als op bewegende koolwaterstoffen, kunnen we de groep onderscheiden die alkynen worden genoemd. Ze behoren tot deze groep vanwege hun structuur - het molecuul bevat alleen koolstof- en waterstofatomen en een van de bindingen tussen de koolstofatomen is onverzadigd. Voor alkynen is dit een C≡C drievoudige binding. Veel vertegenwoordigers van de groep zijn terug te vinden in alledaagse producten zoals benzine, inkt en pesticiden, maar ook in cosmetica, waar ze de rol van antioxidanten bevatten.

De structuur van alkynen
De algemene formule voor alkynen is C n H 2n-2 en elk bevat minimaal één drievoudige binding. Structureel zijn het isomeren van diënen, cycloalkenen en cycloalkenen met twee ringen. Alkynen hebben, net als alkanen of alkenen, een kettingstructuur die recht of vertakt is. Afgezien van de drievoudige binding, wat een covalente binding is, zijn er alleen andere enkelvoudige maar ook covalente CC-bindingen tussen koolstofatomen en CH-bindingen tussen koolstof- en waterstofatomen. De drievoudige binding zal alleen optreden als twee andere koolstofatomen ruimtelijk gelokaliseerd zijn in een lineaire sp hybridisatie. De lengte van deze binding is ongeveer 0,120 nm. Bijvoorbeeld, één koolstofhybride zich samen met de orbitaal van een waterstofatoom om een sp-s (δ sp-s ) covalente sigma-binding te produceren. De tweede binding is gekoppeld aan een analoge sp-sp (δ sp-sp ) sigma-binding, wat leidt tot een andere hybride die zich bij een waterstofatoom vertaalt. onderliggende veranderingen ontstaan in de vorming van het lineaire raamwerk van het molecuul. Door de ontstane sp-hybridisatie zijn er ook twee p-orbitalen loodrecht op de bindingsas aanwezig, uiteindelijk twee π-bindingen tussen de koolstofatomen ontstaan. Er is geen rotatie rond de drievoudige binding.
Alkynes – nomenclatuur
Er zijn verschillende basisprincipes die moeten worden gevolgd bij het benoemen van deze chemische verbindingen:
- De aanwezigheid van een enkele drievoudige binding in de structuur wordt aangegeven door het achtervoegsel ‘-yne’ dat het achtervoegsel ‘-aan’ vervangt in de naam van de relevante alkaanhomoloog. In het geval dat meerdere locaties van een bepaalde binding mogelijk zijn, staat het achtervoegsel ‘-yne’ altijd voor het relevante nummer, waarbij de locatie van de binding wordt aangegeven, zoals hept-2-yne of hept-1-yne. De locatie mag ook aan het begin van de naam staan, bijvoorbeeld 1-butyn.
- Voor structuren die meer dan één drievoudige binding bevatten, wordt een voorvoegsel toegevoegd aan het achtervoegsel om het nummer aan te geven. Dit zijn vermoeden -di, -tri, enz.
- De nummering van koolstofatomen moet een richting aannemen waarin de hoofdketen zoveel mogelijk koolstofatomen bevat die de drievoudige binding bevatten.
- In het geval dat de enige op een dubbele binding de drievoudige binding is, worden de koolstofatomen zo genummerd dat ze het laagst mogelijke aantal hebben. Deze regel is niet van toepassing als er andere op dubbele bindingen (dubbel) zijn, in het geval dat hun locanten zo laag mogelijk moeten zijn.
- In de naam van een verbinding met één drievoudige binding naast de eerste locatie kan het getal worden weggelaten, met andere woorden, de naam prop-1-yne mag naast de naam propyn worden gebruikt
De fysisch-chemische eigenschappen van alkynen
De aard van alkynen is niet-polair, ze zijn hydrofoob en ze reageren met water. Bij voorkeur lossen ze op in parallelle niet-polaire oplosmiddelen zoals alkanen. Naarmate de koolstofketen langer wordt, nemen hun smeltpunt, kookpunt en dichtheid toe. Ondertussen neemt hun activiteit echter af. De meeste reacties zijn die met de minste koolstofatomen in de keten. In vergelijking met alkanen en alkenen zijn ze iets reactiever omdat de drievoudige binding minder is dan een enkele of dubbele binding. Hun moleculaire structuur verklaart ook de hoge ontvlambaarheid van deze verbindingen. Een van de fundamentele reacties van alkynen is de reactie van verbranding. Ze zijn in staat een elektrofiel reagens toe te voegen op de plaats van de op een bewegende binding. Ze ondergaan polymerisatiereacties.
Alkyne homoloog stinkt
Net als alkanen en alkenen hebben ook alkynen hun eigen homologe reeksen, dwz hun hiërarchie van basisverbindingen, die precies één drievoudige binding bevatten, onderkennen volgens het toenemende aantal koolstofatomen in de structuur. De verbinding die de alkyn-homologe ruikt, is ethyn, ook wel acetyleen genoemd, dat twee koolstofatomen en twee waterstofatomen in zijn structuur heeft
| Aantal koolstofatomen in de keten | Alkaan formule | Alkaan naam | Alkyn-formule | Alkyne naam |
| 2 | C 2 H 6 | ethaan | C 2 H 2 | Ethyne |
| 3 | C 3 H 8 | Propaan | C 3 H 4 | Propyn |
| 4 | C 4 H 10 | Butaan | C 4 H 6 | Butyne |
| 5 | C 5 H 12 | pentaan | C 5 H 8 | Pentaan |
| 6 | C 6 H 14 | Hexaan | C 6 H 10 | hexijn |
| 7 | C 7 H 16 | Heptaan | C 7 H 12 | zevenvoudig |
| 8 | C 8 H 18 | Octaan | C 8 H 14 | Octijn |
| 9 | C 9 H 20 | Nonaan | C 9 H 16 | Nonyne |
| 10 | C 10 H 22 | Decaan | C 10 H 18 | Decyne |
Het verkrijgen van alkynen zoals gezien met ethyn
- De reactie van carbide met water:
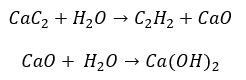
- Pyrolyse:
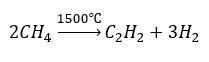
- Synthese bij hoge temperatuur:
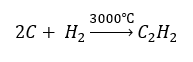
- Gedeeltelijke oxidatie van aardgas:
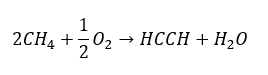
Hogere alkynen worden op industriële schaal verkregen door als reagentia ethyn en bijvoorbeeld formaldehyde in de condensatiereactie te gebruiken. Een andere methode is de tweevoudige eliminatie van waterstofhalogenide uit relevante alkylhalogeniden die twee halogeenatomen omvatten en zijn bevestigd aan één koolstofatoom of aan aangrenzende koolstofatomen. In het laatste geval zijn er twee mogelijke producten: een alkyn en een dieen. basis een voorbeeld van een reactie van propynvorming: 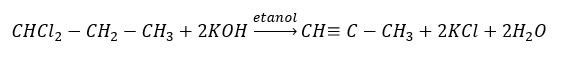
Reacties kenmerkend voor alkynen:
- Totale verbranding met vorming van kooldioxide:
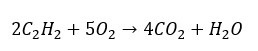
- Gedeeltelijke verbranding met vorming van koolmonoxide van roet:
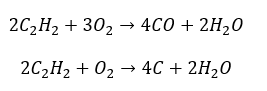
- Hydrogeneringsreactie in aanwezigheid van metaalkatalysatoren (Pd, Pt, Fe, Ni), begrepen in de vorming van alkenen. Het kan in fasen gebeuren, waarbij aanvullende individuele waterstofmoleculen worden toegevoegd, of allemaal tegelijkertijd, met alkaanvorming:
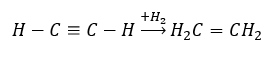
- De Kucherov-reactie, typisch voor alkynen, omvat de toevoeging van een waterdeeltje in het drievoudige bindingsgebied, dat in twee fasen vervalt. aanvankelijk wordt een onstabiel enol gevormd, dat een combinatie is van een alkeen en alcohol. Het ondergaat dan de keto-enol-tautomerie, dwz een hergroepering met de vorming van aldehyden of ketonen. De conversie wordt uitgevoerd door middel van een elektrofiel mechanisme:
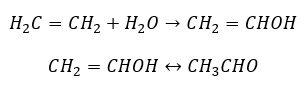
- De elektrofiele additiereactie met HCl of HBr, sterft volgens de regel van Markovnikov. Het kan in zijn geheel of in meerdere stadions voorkomen.
- De elektrofiele toevoeging van bezem, met de productie van di- of tetrabroomderivaten. Door de reacties met bezem verkleuren alkynen broomwater. Ze reageren ook met chloordeeltjes .
- Vrije-radicalfluoride-additiereactie, die wordt uitgevoerd onder invloed van lichtenergie.
- Substitutiereacties, waarbij het waterstofatoom aan het koolstofatoom met drievoudige binding wordt vervangen door een metaalatoom.
- Trimerisatie, dwz polymerisatie met drie moleculen, met behulp van acetyleen, wat de synthese van benzeen mogelijk maakt.
