Aminozuren zijn een groep organische verbindingen waarvan de structuur bestaat uit de atomen koolstof, stikstof, waterstof en zuurstof, evenals een variabele laterale ketengroep. Het zijn bifunctionele verbindingen waarvan de moleculen COOH-carboxylgroepen en NH2 - aminegroepen omvatten.

De algemene formule van aminozuren is als volgt: NH 2 – R – COOH Hun naam is een verkorte vorm van de term “α-aminocarbonzuur”. Als we het hebben over verschillende soorten aminozuren, vervangen we vaak hun systematische namen door gebruikelijke namen. Om een voorbeeld te geven: het aminoazijnzuur wordt glycine genoemd, het 2-aminopropaanzuur wordt alanine genoemd en het 2-amino-3-methylbutaanzuur wordt valine genoemd.
Classificatie van aminozuren
De belangrijkste indeling van aminozuren is in eiwit- en niet-eiwittypen. De eerste groep omvat ongeveer twintig verbindingen, die elk een onderdeel zijn van eiwitten en cruciaal zijn voor het menselijk lichaam. Deze eiwitten, die ook als structurele moleculen in planten en dieren voorkomen, spelen een fundamentele rol door deel te nemen aan veel mechanismen die verantwoordelijk zijn voor het handhaven van de homeostase in het menselijk lichaam. Een andere classificatie houdt rekening met de mogelijkheid om een bepaald aminozuur te produceren of de vereiste toevoer ervan naar het menselijk lichaam samen met voedsel.
Exogene en endogene aminozuren
Exogene aminozuren zijn organische verbindingen die nodig zijn om de homeostase in ons lichaam te behouden, maar ze zijn niet in staat tot zelfproductie. Daarom moeten ze worden verstrekt in de vorm van een passend dieet, samen met goed uitgebalanceerde maaltijden en in de vorm van adequate supplementen. Deze groep aminozuren omvat:
- Lysine – een antivirusaminozuur dat de immuniteit verbetert;
- Methionine, dat de productie van het groeihormoon regelt;
- Threonine, dat verantwoordelijk is voor het goede behoud van vocht in de huid en een goede werking van het zenuwstelsel;
- Leucine, waarvan de belangrijkste rol het controleren van het niveau van uitgescheiden cortisol en suikerniveaus is en het ondersteunen van wondgenezing;
- Isoleucine – een aminozuur dat deelneemt aan spiermetabolismeprocessen, met bijzondere aandacht voor spierweefsel;
- Valine, dat het spierherstel en de verwijdering van overtollig vetweefsel ondersteunt;
- Tryptofaan, een voorloper van serotonine, die de slaapkwaliteit moet verbeteren, de fysieke en mentale toestand moet verbeteren en de eetlust onder controle moet houden;
- Fenylalanine is een voorloper van veel hormonen die belangrijk zijn voor het menselijk lichaam, waaronder tyrosine, dopamine, epinefrine en noradrenaline.
De andere categorie omvat endogene aminozuren , die regelmatig in het menselijk lichaam worden gesynthetiseerd, zodat de vraag ernaar voortdurend op autonome basis wordt gedekt. Deze groep bevat meer aminozuren, waaronder:
- Alanine – een aminozuur dat verantwoordelijk is voor het transport van glucose naar de rode bloedcellen en de hersenen;
- Asparaginezuur, dat de cognitieve functies en het concentratievermogen verbetert;
- Asparagine, dat veel processen ondersteunt, zoals leren, onthouden of concentratieverbetering;
- Glutaminezuur, dat de spijsvertering ondersteunt, het gevoel van vermoeidheid vermindert en het geheugen ondersteunt.
Voorwaardelijke aminozuren
Dit zijn verbindingen die in het lichaam kunnen worden geproduceerd, maar alleen als er toegang is tot de juiste hoeveelheden van hun voorlopers. Voorwaardelijke aminozuren omvatten:
- Arginine, dat veroudering vertraagt, de tijd voor het genezen van wonden verkort en de fysieke fitheid verbetert;
- Cysteïne, een bouwstof bij de vorming van glutathion en een belangrijk productie-element van collageen;
- Glutamine, dat de werking van de darmen ondersteunt en de verwijdering van onnodige stofwisselingsproducten uit het menselijk lichaam;
- Tyrosine, dat net als cysteïne deelneemt aan de aanmaak van collageen, maar ook noodzakelijk is voor de synthese van melanine en helpt de homeostase van de schildklier te behouden;
- Glycine, een aminozuur dat artritis en diabetes kan genezen;
- Ornithine, dat in staat is het cortisolniveau te verlagen, de slaapkwaliteit te verbeteren en de efficiëntie van de darmfuncties en spijsverteringsenzymen te verbeteren;
- Proline, dat de conditie van de huid gunstig beïnvloedt en de flexibiliteit ervan verbetert;
- Serine, gericht op processen die het immuunsysteem en de werking van neuronen ondersteunen.
Eiwit aminozuren
Zoals de naam al doet vermoeden, zijn er ook aminozuren die componenten van eiwitten zijn. Meer specifiek zijn eiwitten verschillende soorten aminozuren die met elkaar zijn gecombineerd. Het zijn er twintig, en tijdens de synthese worden ze gecodeerd door zogenaamde codons (sequenties van drie nucleotiden in het mRNa, die de coderende eenheid vormen). Elk van hen heeft twee gemeenschappelijke kenmerken: het zijn alfa- en L-aminozuren. Dit betekent dat hun aminegroep verbonden is met de alfakoolstof, die direct grenst aan de carbonylgroep. De letter “L” staat voor een stereo-isomeer in de Fischer-projectie, dus de aminegroep bevindt zich aan de linkerkant van de formule. 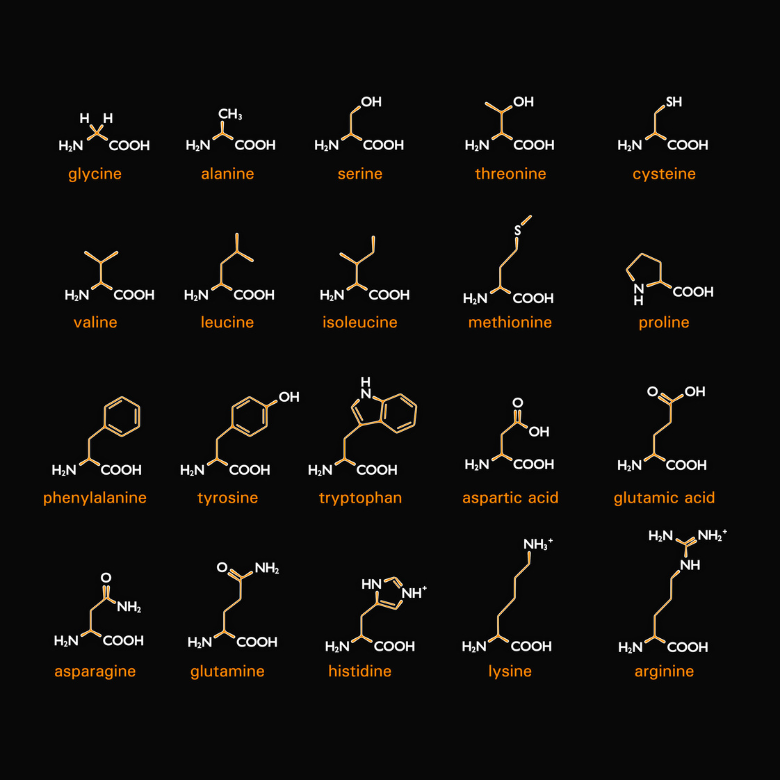
De fysisch-chemische eigenschappen van aminozuren
De fysieke vorm van aminozuren is gewoonlijk een kristallijne vaste stof met een zoete smaak. Hun oplosbaarheid in water is goed, maar ze lossen niet op in organische oplosmiddelen. Hun smeltpunten zijn relatief hoog. De chemische aard van aminozuren is amfoteer en de reactie van hun waterige oplossingen is neutraal. Dissociatie produceert dubbele ionen, die het resultaat zijn van het neutraliseren van de basische aminegroep met een carboxylradicaal. Dit resulteert in de productie van een intern ammoniumzout dat beide ladingen vertoont: positief en negatief. Hun hoeveelheden zijn gelijk. Een aminozuur kan bestaan als kation of anion, afhankelijk van de omgeving waarin het dissocieert. Bij zure reacties dissocieert de carboxylgroep niet en heeft het aminozuur een positieve lading. In een alkalische omgeving verschuiven de reacties naar het produceren van een negatief ion.
Het iso-elektrische punt (pI)
Het is een punt waarop een aminozuur de vorm aanneemt van een dubbel ion. Voor elk molecuul kunnen we een adequate concentratie van [H 3 O +] ionen aanpassen, wat een pH betekent waarbij ionen niet bewegen in het elektrische veld. De amfotere aard van aminozuren en hun bestaan in de vorm van dubbele ionen impliceert een ionische structuur van zouten wanneer ze worden beïnvloed door zuren en alkaliën. Experimentele bepaling van het iso-elektrische punt wordt uitgevoerd door een aminozuur, bijvoorbeeld caseïne, toe te voegen aan geschikte reageerbuizen die oplossingen ( CH3COOH en CH3COONa ) met bekende pH-concentraties bevatten. Het iso-elektrische punt wordt bereikt waar de afzetting het meest voorkomt. Gezien het kenmerk van het iso-elektrische punt kunnen we het gebruiken om een mengsel van eiwitten te scheiden met behulp van elektroforese. Deze methode is gebaseerd op de zuur-basische eigenschappen van aminozuren en het mengsel wordt op bevochtigd papier geplaatst. Met behulp van een bekende pH kunnen we bepalen in welke vorm bepaalde aminozuren zullen voorkomen. Als we vervolgens spanning op het papier zetten, zullen de positief geladen aminozuren naar de kathode bewegen (-), en die met een negatieve lading naar de anode (+). De neutraal geladen verbindingen, in evenwicht gehouden door de positieve en negatieve ladingen in het molecuul, zullen op dezelfde plaats blijven.
Reacties die kenmerkend zijn voor de carboxylgroep
- Verestering, die bestaat uit het synthetiseren van esters die worden geproduceerd door een reactie tussen een aminozuur en een alcohol. Het product van een dergelijke reactie vertoont geen amfoteer karakter, maar vertoont wel de eigenschappen van het gebruikte amine.
- Decarboxylering, dat wil zeggen het verwarmen van een aminozuur in aanwezigheid van een barium(II)hydroxide (Ba(OH) 2 )-oplossing. De transformatie produceert aminen.
- De productie van complexen houdt verband met het vermogen van aminozuren om zich te binden met de kationen van een metaal, voornamelijk koper, wat de vorming van gekleurde verbindingen (complexe zouten) veroorzaakt.

Reacties die kenmerkend zijn voor de aminegroep
- Deaminatie, waarbij aminozuren betrokken zijn die de primaire aminegroep bevatten. De reactie vindt plaats onder invloed van salpeter(III)zuur ( HNO2 ), en het aminozuur dat als reactant wordt gebruikt, oxideert en produceert een waterstofzuur. De aminegroep komt vrij in de vorm van stikstof. Er zijn verschillende soorten deaminatie, waaronder hydrolytische deaminatie, hydrolytische deaminering met decarboxylering, deaminatie door reductie en desaturatiedeaminatie.
- Oxidatie, waardoor aminozuren worden omgezet in ketozuren.
- Biochemische reacties – alle aminozuren die kunnen worden geclassificeerd als Schiff-basen zijn in staat tot biochemische transformaties zoals transmissie en decarboxylering.
Reacties gebruikt voor het detecteren van aminozuren
- De ninhydrinereactie is een gekleurde reactie waarbij de reactanten een aminozuur en een reagens in de vorm van een ninhydrine-oplossing zijn. De reactie produceert een karakteristieke violetblauwe kleur.
- De xanthoproteïnereactie is een voorbeeld van de manier waarop aromatische aminozuren, zoals fenylalanine, tyrosine of tryptofaan, kunnen worden gedetecteerd. Een verbinding die wordt onderworpen aan een geconcentreerde oplossing van salpeterzuur (V) zuur (HNO 3 ) verandert van kleur in geel. Het is een resultaat van de productie van salpeteraminozuurderivaten tijdens de reactie.
Bronnen van aminozuren
Om een goede fysieke en mentale conditie van het menselijk lichaam te garanderen, moeten we het voorzien van de juiste hoeveelheden van elk bouwmateriaal, inclusief aminozuren. Een uiterst belangrijke bron van alle aminozuren die nodig zijn voor een goede werking zijn de complete eiwitten. Hieronder vallen vlees, met name gevogelte, vis, eieren en zuivelproducten. Melk bevat grote hoeveelheden leucine, isoleucine, threonine en tryptofaan. Lysine en methionine zijn te vinden in soja. Valine kan samen met rijst, pinda’s, sesam en amandelen worden geleverd, en fenylalanine, door eieren, kaas en graanproducten in onze voeding op te nemen. De aanwezigheid van aminozuren in voedingsproducten is gebruikelijk, maar om ons dieet goed in balans te houden, moeten de producten die we gebruiken gediversifieerd zijn. Dit komt omdat ze alleen bepaalde aminozuren bevatten uit de groep die nodig is om goede vitale functies te behouden.
