Kijkend naar hun structuur, zijn carbonzuren belangrijke organische verbindingen en het zijn acylderivaten. Ze zijn een soort bouwmaterialen voor veel derivaten, waaronder esters en amiden. In de natuur kunnen we een hele reeks verschillende carbonzuren vinden, zoals azijnzuur CH 3 COOH, de basisverbinding van tafelazijn, boterzuur CH 3 CH 2 CH 2 COOH verantwoordelijk voor de geur van ranzige boter, of meer complex cholzuur, dat het basisbestanddeel is van menselijke galsappen.

De algemene formule van carbonzuren is:
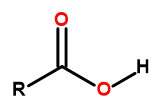
Figuur 1 De algemene formule van carbonzuren is:
Nomenclatuur van carbonzuren
Volgens het IUPAC-nomenclatuursysteem kunnen carbonzuren op twee manieren worden genoemd, afhankelijk van de grootte en complexiteit van het molecuul. Zuren die alifatische derivaten zijn, worden systematisch benoemd door het alkaanuiteinde te veranderen van -ane in -oic en het beginwoord "acid" toe te voegen, bijvoorbeeld propaanzuur, butaanzuur, 3-ethyl-6-methyloctaandizuur. De nummering van koolstofatomen in dergelijke chemische verbindingen begint altijd met het atoom in de –COOH functionele groep. Het tweede naamgevingssysteem, vooral handig voor zuren waarin de carboxylgroep aan de ring is bevestigd, is toegestaan om de woorden "zuur" ervoor en "carbonzuur" erna toe te voegen aan de systematische naam van de verbinding. In dergelijke gevallen begint de nummering van de koolstofatomen met het atoom waaraan de carboxylgroep is bevestigd, die zelf wordt behandeld als een substituent.
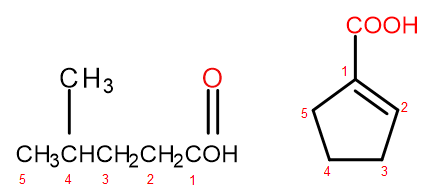
Figuur 2 Nummering van koolstofatomen in, van links naar rechts: 4-methylpentaanzuur, 1-cyclopenteencarbonzuur.
| Carbonzuur | Acyl groep | ||
| Structuur | Naam | Structuur | Naam |
| HCOOH | Mierenzuur | HCO- | Formyl- |
| CH 3COOH | Azijnzuur | CH 3 CO- | Acetyl- |
| CH 3 CH 2 CH 2 COOH | Boterzuur | CH 3 CH 2 CH 2 CO- | Butyryl- |
| HOOOCCOOH | Oxaalzuur | -OCCO- | Oxalil- |
| HOOC (CH2) 2COOH | barnsteenzuur | -OC(CH 2 ) 2 CO- | succinyl- |
De structuur en fysische eigenschappen van carbonzuren
De gelijkenis van de carboxylgroep met zowel ketonen als alcoholen kan vergelijkbare fysische eigenschappen suggereren. Net als bij ketonen heeft het koolstofatoom van de functionele groep een sp 2 hybridisatie. Dit houdt rechtstreeks verband met de platte structuur en hoeken van ongeveer 120 o tussen de CCO- en OCO-bindingen. Azijnzuur CH 3COOH heeft bijvoorbeeld bindingshoeken gelijk aan:
- 119 o voor CC=O,
- 119 o voor CC-OH,
- 122 o voor O=C-OH.
De bindingslengtes zijn als volgt:
- 52Å voor CC,
- 25Å voor C=O,
- 31Å voor C-OH.
Carbonzuren tonen hun gelijkenis met alcoholen vanwege hun sterke associatie die wordt veroorzaakt door de mogelijkheid om waterstofbruggen te vormen. In de praktijk komen de meeste van deze verbindingen voor als cyclische dimeren waarvan de structuur wordt behouden door de vorming van waterstofbruggen. Zo’n specifiek systeem van waterstofbruggen heeft ook invloed op de kookpunten van carbonzuren. Het veroorzaakt hun aanzienlijke toename in vergelijking met de overeenkomstige alcoholen. Fysische constanten – het smeltpunt en het kookpunt in graden Celsius zijn bijvoorbeeld respectievelijk:
- Mierenzuur : 8,4; 100,7,
- Azijnzuur: 16,6; 117,9,
- Propaanzuur: -20,8; 141,
- Benzoëzuur: 122,1; 249.
Dissociatie van carbonzuren
De zure eigenschappen van deze groep verbindingen maken het mogelijk dat ze reageren met basen, waaronder natriumhydroxide en kaliumbicarbonaat. De producten van dergelijke reacties zijn zouten van carbonzuren. De oplosbaarheid van carbonzuren in water is verwaarloosbaar, maar hun zouten met alkalimetalen lossen vanwege hun ionische structuur zeer goed op in water. Deze verbindingen, die zuren zijn in de Bronsted-Lowry-theorie, dissociëren in verdunde waterige oplossingen. Als resultaat van de omzetting worden het carboxylaatanion RCOO – en het hydroniumkation H 3 O + gevormd.
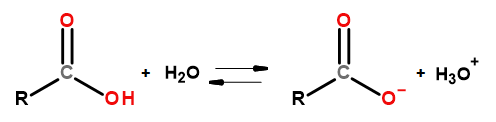
Figuur 3 Schema van carbonzuurdissociatie.
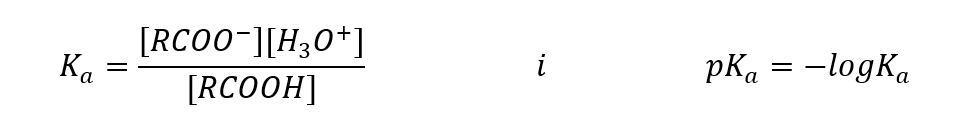 Empirisch bepaalde waarden voor carbonzuren laten zien dat het zwak gedissocieerde verbindingen zijn, dus in de praktijk zijn het ook zwakke zuren. Voor de meeste van hen heeft de K a -constante een waarde van ongeveer 10 -5 . Voor azijnzuur is Ka = 1,76·10 -5 , wat na omrekening de pK een waarde geeft gelijk aan 4,75. Dit komt overeen met de dissociatie van slechts ongeveer 0,1%van de moleculen, wat, vergeleken met sterke anorganische zuren met een dissociatiegraad van 100%, bevestigt dat dit zuren met een lage sterkte zijn. Vergeleken met alcoholen, waarvan de evenwichtsconstanten oscilleren in de orde van grootte van 10 -16 , zijn carbonzuren veel sterker. Ondanks hun structurele gelijkenis is dit feit te wijten aan de stabiliteit van het carboxylaatanion ten opzichte van het alkoxide-anion. Merk op dat de negatieve lading in alkoxiden zich op een enkel zuurstofatoom bevindt, dat sterk elektronegatief is. Daarentegen is bij carboxylaatanionen de lading gedelokaliseerd tussen de twee zuurstofatomen van de functionele groep. Dit maakt het stabieler in vergelijking met het anion geproduceerd door alcoholen.
Empirisch bepaalde waarden voor carbonzuren laten zien dat het zwak gedissocieerde verbindingen zijn, dus in de praktijk zijn het ook zwakke zuren. Voor de meeste van hen heeft de K a -constante een waarde van ongeveer 10 -5 . Voor azijnzuur is Ka = 1,76·10 -5 , wat na omrekening de pK een waarde geeft gelijk aan 4,75. Dit komt overeen met de dissociatie van slechts ongeveer 0,1%van de moleculen, wat, vergeleken met sterke anorganische zuren met een dissociatiegraad van 100%, bevestigt dat dit zuren met een lage sterkte zijn. Vergeleken met alcoholen, waarvan de evenwichtsconstanten oscilleren in de orde van grootte van 10 -16 , zijn carbonzuren veel sterker. Ondanks hun structurele gelijkenis is dit feit te wijten aan de stabiliteit van het carboxylaatanion ten opzichte van het alkoxide-anion. Merk op dat de negatieve lading in alkoxiden zich op een enkel zuurstofatoom bevindt, dat sterk elektronegatief is. Daarentegen is bij carboxylaatanionen de lading gedelokaliseerd tussen de twee zuurstofatomen van de functionele groep. Dit maakt het stabieler in vergelijking met het anion geproduceerd door alcoholen.
Het verkrijgen van carbonzuren
- Oxidatie van gesubstitueerde alkylbenzenen met KMnO 4 of Na 2 Cr 2 O 7 met het product in de vorm van gesubstitueerde benzoëzuren. Het is mogelijk primaire en secundaire alkylgroepen te oxideren,
- Oxidatie van de C=C-binding in alkenen met ten minste één vinylwaterstofatoom met behulp van KMnO 4 ,
- Oxidatie van primaire alcoholen en aldehyden. Alcoholen die het Jones-reagens gebruiken, aldehyden die hetzelfde reagens gebruiken en basisch zilveroxide,
- Hydrolyse van nitrillen onder invloed van sterke, hete oplossingen van zuren of basen,
- De reactie van Grignard-verbindingen met kooldioxide, met een tussenproduct in de vorm van magnesiumcarboxylaat. De overgangsverbinding reageert dan met het zuur.
Reacties van carbonzuren
Vanwege hun structuur ondergaan carbonzuren, naast hun karakteristieke reacties, ook transformaties die vergelijkbaar zijn met die van alcoholen en ketonen. Net als alcoholen kunnen ze een proton dissociëren om een nucleofiel reagens te vormen. Net als ketonen zijn ze onderhevig aan aanvallen door andere nucleofielen op het koolstofatoom van de carbonylgroep. Bovendien zijn hun reductie, substitutie in de alfapositie, nucleofiele substitutie van de acylgroep en deprotonering (dissociatie) mogelijk. Reductie van carbonzuren vindt plaats met LiAlH 4 , waardoor het product een primaire alcohol wordt. Soms is het nodig om verwarming toe te passen in een tetrahydrofuranoplossing om de efficiëntie te verhogen. Een andere methode is een reductie met behulp van boraan in tetrahydrofuranoplossing, waarbij ook 1 o alcoholen worden verkregen.
