In het geval van chemische reacties wordt slechts bij een klein deel ervan een volledige omzetting van substraten in producten waargenomen. De overgrote meerderheid, inclusief die welke in ons lichaam voorkomen, is omkeerbaar. Voor dergelijke processen wordt een toestand van chemisch evenwicht tot stand gebracht. Dit is een uiterst belangrijk concept in de chemie, dat wordt geassocieerd met bijvoorbeeld het principe van Le Chatelier (of de evenwichtswet). Kennis van de basiswetten en -principes rond chemisch evenwicht maakt het bijvoorbeeld mogelijk om veel reacties te voorspellen of technologische processen efficiënter te laten verlopen.
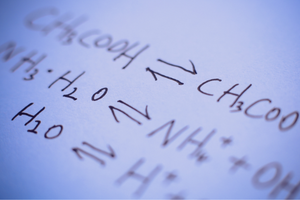
Omkeerbare en onomkeerbare reacties
Rekening houdend met het verloop van chemische reacties kan er een algemene indeling worden gemaakt – in omkeerbare en onomkeerbare reacties. Er moet echter aan worden herinnerd dat er in werkelijkheid geen 100%onomkeerbare reacties zijn en dat de kwalificatie voor een bepaalde groep is gebaseerd op het heersende uiteindelijke effect.
Onomkeerbare reacties
In dit geval reageren de substraten in het systeem en resulteren in specifieke producten. Er is echter geen omgekeerde transformatie – producten in substraten . In de formule is een enkele pijl gemarkeerd tussen de reactanten en de pijl wijst naar de producten. Onomkeerbare reacties zijn in de eerste plaats alle reacties waarbij zich neerslagen vormen. In de praktijk zijn ze onoplosbaar in water en kunnen ze niet worden gereconstitueerd. Omkeerbaarheid van het proces is ook moeilijk te bereiken in het geval van reacties die plaatsvinden in open systemen, dwz in een beker of een bolvormige kolf, waaruit een van de resulterende producten, bijvoorbeeld koolstofdioxide, vrij kan ontsnappen, maar door de omstandigheden te veranderen van de reactie, dwz door deze over te brengen naar een gesloten systeem, kan deze omkeerbaar worden gemaakt. Tot de groep onomkeerbare reacties behoren ook alle processen waarbij de interactie tussen productmoleculen in veel mindere mate plaatsvindt dan tussen substraten. Een dergelijk proces vindt dus in beide richtingen plaats, maar vanwege het feit dat de reconstitutie van de substraten verwaarloosbaar is, worden ze in de praktijk geclassificeerd als onomkeerbare reacties.
Omkeerbare reacties
Dit zijn reacties waarbij producten worden gevormd uit substraten en tegelijkertijd vindt met vergelijkbare intensiteit het omgekeerde proces plaats, namelijk de reconstitutie van substraten uit producten. In de reactieformule worden twee pijlen tussen de reactanten geplaatst, waarbij de pijlen in tegengestelde richting wijzen, om de omkeerbaarheid van de plaatsvindende reacties aan te geven. Omkeerbare reacties zijn voornamelijk reacties die worden uitgevoerd in gesloten systemen. Moleculen van substraten en producten kunnen de reactieomgeving niet verlaten en botsen met elkaar, waardoor producten ontstaan en substraten opnieuw worden samengesteld. Een voorbeeld van zo’n reactie is de productie van joodwaterstof uit jodium en waterstof.
De toestand van chemisch evenwicht
Of een bepaalde reactie kan optreden, of deze omkeerbaar of onomkeerbaar is, hangt grotendeels af van de specifieke procesomstandigheden en het type proces. Als er een reversibele reactie plaatsvindt, dwz substraten veranderen in producten als gevolg van een chemische reactie en tegelijkertijd als gevolg van botsingen van productmoleculen, ondergaan substraten recreatie, dan op een bepaald moment wanneer deze reacties optreden, er wordt een toestand van chemisch evenwicht bereikt . Met andere woorden, de concentraties van substraten en producten in het systeem zijn op een constant niveau – hun hoeveelheid verandert niet ondanks de continue reactie. In de chemische evenwichtstoestand zijn de reactiesnelheden in beide richtingen gelijk. Het chemische evenwicht betekent onder bepaalde omstandigheden de meest stabiele toestand voor een bepaald systeem. De energiebehoefte is dan zeer laag. De chemische evenwichtsconstante, K , is een coëfficiënt die het evenwicht van twee omkeerbare reacties beschrijft. Het wordt gedefinieerd als het quotiënt van de concentraties van producten en substraten verhoogd tot de machten die overeenkomen met de stoichiometrische coëfficiënten die werden gemeten in de chemische evenwichtstoestand. De formule voor de constante werd in 1864 afgeleid als de zogenaamde wet van massale actie. Er moet aan worden herinnerd dat dit een karakteristieke waarde is voor een bepaalde reactie. Een aantal factoren beïnvloeden de toestand van het chemisch evenwicht. Dit zijn er een paar:
- Temperatuur,
- volume van het reactiesysteem,
- druk,
- concentratie van reactanten.
Wat belangrijk is, is dat de positie van de evenwichtstoestand niet wordt beïnvloed door de toevoeging of verandering van de reactiekatalysator. Zijn taak is alleen om de tijd te verkorten waarin het evenwicht wordt bereikt. 
Het principe van Le Chatelier (de evenwichtswet)
Door bepaalde reactiecondities te veranderen, kunnen we het evenwicht ervan beïnvloeden. Het systeem zal altijd streven naar het handhaven van het evenwicht, omdat het energetisch gunstig voor hem is (laagste energieverbruik). Als gevolg hiervan zullen er veranderingen zijn die de factoren die het systeem uit balans brengen tegengaan. Dit fenomeen werd in 1881 verklaard en staat tegenwoordig bekend als het principe van Le Chatelier-Braun of als de evenwichtswet. Het maakt het mogelijk om de reactie van het systeem op veranderingen in de omstandigheden van een reactie te begrijpen, die zich in een staat van chemisch evenwicht bevindt. De toevoeging van een van de reagerende stoffen aan het systeem veroorzaakt een verstoring van het evenwicht. De concentraties van individuele reactanten veranderen. Om dit tegen te gaan, heeft het systeem de neiging om meer product te produceren (wanneer een substraat is toegevoegd) of om het substraat opnieuw samen te stellen (wanneer een bepaalde hoeveelheid product is toegevoegd). Het veranderen van de reactietemperatuur heeft een enorme impact, vooral voor endotherme en exotherme processen. In het eerste geval is het nodig om energie aan het systeem toe te voeren in de vorm van warmte, dus door de temperatuur van het hele proces te verhogen, zal het evenwicht naar rechts verschuiven (naar links zakken), in de richting van de vorming van meer product. . Het tegenovergestelde zal het geval zijn voor exotherme reacties, waarbij een van de producten warmte is. De temperatuur heeft geen effect op het evenwicht van de reactie, waar geen thermisch effect wordt waargenomen. Bij reacties die plaatsvinden in de gasfase is druk een zeer belangrijk aspect. Door de waarde van deze parameter te verhogen, dwz het reactievolume van het systeem te verkleinen, verschuift het reactie-evenwicht. De richting van veranderingen hangt af van de stoichiometrische coëfficiënten in de reactievergelijking. Deze parameter heeft geen invloed op het chemische evenwicht van de reactie waarin de som van de stoichiometrische coëfficiënten van de gasvormige substraten en producten hetzelfde is. Het is de moeite waard eraan te denken dat wanneer het systeem uit het chemische evenwicht wordt gegooid, de evenwichtswet van toepassing zal zijn en als gevolg daarvan een nieuwe evenwichtstoestand zal worden bereikt.
