Per definitie is chemische activiteit het vermogen van een element om elektronen te doneren bij chemische reacties. In de praktijk neemt hun activiteit toe met afnemende elektronegativiteit - een maatstaf voor het vermogen van een element om elektronen aan te trekken. Als een metaal niet sterk elektronen aantrekt, is het reactiever. Een referentie-element, waterstof, wordt gebruikt om de chemische activiteit van metalen te classificeren. Een maatstaf voor de activiteit van een metaal is het vermogen ervan om waterstof uit zuren of waterstof uit een watermolecuul te verdringen.

Chemische activiteitsreeks van metalen
Deze term wordt gebruikt om de samenvatting te beschrijven van chemische elementen die metallisch van aard zijn, in een specifieke volgorde van minst tot meest chemisch actief. Dit wordt gebruikt om de activiteit van verschillende metalen te vergelijken. Naast metalen omvat de reeks chemische activiteiten ook één niet-metaal, waterstof , dat het referentie-element is. Hoe hoger in de activiteitenreeks een metaal staat, hoe reactiever het is . Het houdt ook verband met het feit dat het gemakkelijker wordt geoxideerd en daarom een sterker reductiemiddel en een chemisch actiever element is. Daarentegen geldt dat hoe lager in de activiteitenreeks een metaal wordt geplaatst, hoe minder reactief het is. Dit betekent dat het gemakkelijker een reductiereactie ondergaat en dus een sterker oxidatiemiddel is, een minder actief element. Met behulp van de waarden in Tabel 1 kunnen we zien dat hoe lager de waarde van het standaardpotentieel van een element, hoe sterker het reductiemiddel en hoe chemisch reactiever het metaal. Een maatstaf voor het vermogen om elektronen te doneren bij een reeks metaalactiviteiten is hun standaard potentiële waarde . Voor waterstof, of beter gezegd de waterstofelektrode, wordt aangenomen dat de standaardpotentiaal nul is. Het standaardpotentiaal is de elektromotorische kracht van een cel die bestaat uit een standaard waterstof-halfcel en de andere halfcel waarin de concentraties van substraten en producten 1 mol/dm 3 bedragen.
| Elektrode | Standaardpotentiaal [V] |
| Li/Li + | -3,04 |
| Ca/Ca2 + | -2,86 |
| Mg/Mg3 + | -2,36 |
| Al/Al 3+ | -1,69 |
| Mn/Mn 2+ | -1,18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr3 + | -0,74 |
| Fe/Fe 2+ | -0,44 |
| cd/cd 2+ | -0,40 |
| Co/Co2 + | -0,28 |
| Ni/Ni2 + | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb2 + | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu2 + | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg2 + | +0,85 |
| Au/Au 3+ | +1,52 |
Tafel 1 . Elektrochemische reeks metalen De metalen bovenaan de reeks zijn het meest actief. Degenen boven waterstof hebben de neiging gemakkelijk te oxideren en zijn daarom sterkere reductiemiddelen dan waterstof. Elementen onder waterstof in de reeks worden gemakkelijker gereduceerd en zijn sterkere oxidatiemiddelen. Als een metaal een negatiever potentieel heeft dan een ander, betekent dit dat het het uit zijn zout zal verdringen. IJzer zal bijvoorbeeld koper in koperzouten verdringen, maar koper zal ijzer niet uit zijn zouten verdringen. In plaats daarvan kan het zilver uit zilverzouten verdringen. Lithium en beryllium uit oplossingen van zouten van andere metalen verdringen ze niet, maar reageren direct met water. Ze verdringen waterstof en produceren hun verbindingen: hydroxiden . Dergelijke metalen worden actieve metalen genoemd. Metaalactiviteit en het periodiek systeem der elementen Net als veel andere eigenschappen kan de chemische activiteit van een element worden afgeleid uit zijn positie in het periodiek systeem . De meest actieve metalen zijn die uit de groepen I en II, omdat ze gemakkelijk waterstof uit water verdringen om hydroxiden te vormen. In de groep neemt de chemische activiteit van metalen toe met toenemend atoomnummer . De periode neemt af naarmate het atoomnummer toeneemt. 
Edel- en onedele metalen
Waterstof biedt niet alleen een referentiepunt voor activiteit, maar scheidt ook edele en onedele metalen in de reeks . Basismetalen zijn die boven waterstof. Elk reageert met zuren en verdringt waterstof daaruit. Van kalium tot calcium reageren ze al bij kamertemperatuur met water, en van magnesium tot ijzer reageren ze ermee bij verhoogde temperaturen. Alle metalen die zich in de activiteitenreeks onder waterstof bevinden , verdringen waterstof niet uit zuren . Ze kunnen echter reageren met oxiderende zuren en zo de overeenkomstige zouten en oxiden vormen, die worden gevormd door het zuurresidu te reduceren. De elementen onderaan de serie, van zilver tot goud, zijn zo goed bestand tegen chemische reacties dat ze alleen reageren met koningswater . Zo’n oplossing is een mengsel van een geconcentreerde oplossing van zoutzuur en een geconcentreerde oplossing van salpeterzuur (V) , gemengd in een volumeverhouding van 3:1. Als we deze feiten kennen, kunnen we concluderen dat er verschillende reacties kunnen worden uitgevoerd om de activiteit van het element te onderscheiden: met water op kamertemperatuur, met heet water, met niet-oxiderend zuur, met oxiderend zuur en met koningswater.
Experimenteer om metalen te detecteren die waterstof uit zuren verdringen
De eenvoudigste manier om metaalactiviteit te bevestigen is door een experiment uit te voeren. Hiervoor moeten tien reageerbuisjes worden klaargemaakt waarin achtereenvolgens wordt geplaatst: in 1-5: magnesiumlint, zinkdraad, ijzerdraad, nikkeldraad en koperdraad. Dezelfde volgorde moet worden herhaald in buizen 6-10. Voeg enkele milliliter zoutzuur toe aan buisjes 1-5 en enkele milliliter verdund zwavelzuur (VI) aan buisjes 6-10. Breng een brandende spalk aan op elke buis. In reageerbuizen die magnesiumlinten en ijzer-, zink- en nikkeldraden bevatten, overspoeld met zuren, komen gasbellen vrij. De meest intense afgifte kan worden waargenomen in buizen die magnesium bevatten. De reacties die plaatsvinden zijn als volgt: 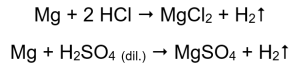 De hoeveelheid uitgestoten gas neemt af in de reeks: zink, ijzer, nikkel. De volgende reacties vinden dienovereenkomstig plaats:
De hoeveelheid uitgestoten gas neemt af in de reeks: zink, ijzer, nikkel. De volgende reacties vinden dienovereenkomstig plaats:  In buizen waarin koperdraden zaten, is geen gas zichtbaar, geen verandering. Dit betekent dat dergelijke reacties niet optreden:
In buizen waarin koperdraden zaten, is geen gas zichtbaar, geen verandering. Dit betekent dat dergelijke reacties niet optreden: 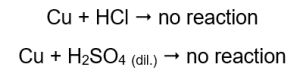 Wanneer een brandende spalk wordt aangebracht, is er een kenmerkend geluid hoorbaar in de buizen waaruit het gas wordt uitgestoten.
Wanneer een brandende spalk wordt aangebracht, is er een kenmerkend geluid hoorbaar in de buizen waaruit het gas wordt uitgestoten.
Samenvatting van observaties en conclusies:
Magnesium, zink, ijzer en nikkel reageren met zowel zoutzuur als zwavelzuur (VI). Elk verdringt waterstof uit het zuur, wat betekent dat ze hoger in de metaalactiviteitsreeks staan dan het zuur. Bij de reacties ontstaan producten in de vorm van zouten en een gas, waterstof, dat vrijkomt. Het kenmerkende geluid dat gepaard gaat met het aanbrengen van een gloeiende spalk op een reageerbuis met ontsnappend gas wordt veroorzaakt door de reactie van waterstof met zuurstof. Van alle geteste metalen is magnesium het meest reactief, gevolgd door zink, ijzer, nikkel en koper. Dat kunnen we zien omdat de intensiteit van de gasbellen de activiteit van het metaal aangeeft. Bij buizen die koper bevatten werden geen veranderingen waargenomen. Dit toont aan dat koper niet in staat is waterstof uit zoutzuur of verdund zwavelzuur (VI) te verdringen.
