De energie van chemische reacties is een van de belangrijke elementen die ons in staat stellen de transformaties te begrijpen die optreden in een chemische reactie. Bij zo’n transformatie ontstaan chemische verbindingen met een andere structuur en chemische samenstelling dan de grondstoffen waarvan ze gemaakt zijn. Tijdens een chemische reactie worden de bestaande bindingen tussen de atomen van de moleculen die als reactanten worden gebruikt, verbroken en worden nieuwe bindingen geproduceerd - aanwezig in de producten.

Het systeem en de omgeving van een chemische reactie
Voor de juiste interpretatie van een chemische reactie in termen van energie, moeten we enige kennis hebben over het volgende:
- Systeem: een afgescheiden gebied van materie met duidelijke grenzen. Het type systeem is belangrijk: het is open als de reactie de uitwisseling van energie en materie inhoudt, gesloten als de reactie alleen de uitwisseling van energie betreft, of geïsoleerd als er geen energie of materie wordt uitgewisseld.
- Omgeving: alles wat niet in het systeem is opgenomen maar wel in de buurt is.
- Systeemcomponenten: alle stoffen die zich in het geanalyseerde systeem bevinden en hun karakteristieke chemische eigenschappen hebben.
De energie van chemische bindingen
Het energie-effect dat elke chemische reactie kenmerkt, is het resultaat van veranderingen die optreden tijdens het afbreken en het produceren van nieuwe bindingen tussen atomen. Het feit is dat elke breuk van een chemische binding intrinsiek verbonden is met de absorptie van een geschikte hoeveelheid energie, terwijl de vorming van een nieuwe binding de productie van energie veroorzaakt. Het vrijkomen van energie aan de omgeving kan verschillende effecten hebben: warmte, licht, werk of elektriciteit. Elk van deze processen is een componentfactor die de algemene verandering in de interne energie van het systeem waarin de reactie plaatsvindt beïnvloedt. Het is belangrijk dat, ongeacht of de reagentia tijdens de transformatie energie moeten opnemen of afstaan, er altijd een bepaalde hoeveelheid energie nodig is om het hele proces op gang te brengen.
De eerste wet van de thermodynamica
De eerste belangrijke regel met betrekking tot de energie van chemische reacties is de relatie geformuleerd in de eerste wet van de thermodynamica, die stelt dat de interne energie van een systeem dat alleen energie uitwisselt met de omgeving (een gesloten systeem) alleen kan worden omgezet in warmte of arbeid. Dit wordt weerspiegeld in de Helmholtz-vergelijking: ∆U = Q + W Waar ΔU staat voor de verandering in interne energie, Q staat voor warmte en W staat voor arbeid. We kunnen uit de formule opmaken dat de interne energie van een geïsoleerd systeem, dat wil zeggen een systeem dat geen energie of massa uitwisselt met de omgeving, constant is. Componenten van de interne energie zijn alle kinetische energieën van atomen, ionen, moleculen, elektronen en componenten van de atoomkern, die zich momenteel in het reactiesysteem bevinden, evenals de energieën van hun interacties, dat wil zeggen de energieën van chemische bindingen, interacties tussen kosten, enzovoort. Houd er rekening mee dat de interne energie geen kinetische of potentiële energie van het systeem als geheel bevat. De som van kinetische en potentiële energieën van het systeem als geheel en de interne energie is de totale energie van het systeem (E).
Systeementhalpie (H)
Dit is een ander belangrijk concept dat verband houdt met de energie van chemische reacties, wat in de praktijk de som betekent van de interne energie van het systeem en het product van de druk en het volume. In kwalitatieve termen is het de energie die nodig is om een systeem in vacuüm (U) te produceren, verhoogd met arbeid, dwz het quotiënt van druk en volume (pV), dat het systeem moet presteren tegen externe krachten in om een volume te bereiken dat verschilt van nul. De relatie die de enthalpie van een systeem definieert, wordt als volgt uitgedrukt: H = U + pV Een in zo’n systeem optredende reactie veroorzaakt een oneindig kleine verandering in enthalpie: dH = dU + dpV + pdV Als de reactieomstandigheden isobaar zijn, dus als de druk tijdens het proces verandert niet, het tweede deel kan worden weggelaten, omdat dpV=0. Na het vervangen van differentiëlen voor bepaalde toenamen en na het vervangen van de uitdrukking die verwijst naar de verandering van de interne energie van het systeem, verkrijgen we de volgende relatie: ∆H = Q + W + p∆V Ervan uitgaande dat het geanalyseerde proces een volumetrisch werk uitvoert bij een constante druk , dan W = -pΔV, en dus: ∆H = Q – p∆V + p∆V Uit de vergelijking volgt dat als de reactie plaatsvindt bij een constante druk, de verandering in de enthalpie van het systeem gelijk is aan de warmte: ∆H = Q
Energetische mogelijkheden van een reactie
Op basis van de hierboven afgeleide formule, die aangeeft dat de verandering in de enthalpie van het systeem gelijk kan zijn aan de reactiewarmte, worden processen geclassificeerd volgens thermische transformaties. In termen van de richting van de energiestroom verdelen we chemische reacties in:
- Exotherme reacties, dit zijn reacties waarbij we de emissie van energie, bijvoorbeeld in de vorm van warmte, naar de omgeving van het systeem kunnen waarnemen. Dit gebeurt wanneer de som van de enthalpieën van de producten lager is dan de som van de enthalpieën van de substraten, dus als ΔH<0.
- Endotherme reacties, dus zulke chemische reacties die ervoor zorgen dat energie uit de omgeving wordt opgenomen. Een voorwaarde voor een dergelijke reactie is het leveren van een geschikte hoeveelheid van die energie. Dit geldt voor alle transformaties waarbij de totale enthalpie van de producten hoger is dan de totale enthalpie van de substraten, dus ΔH>0.
Notaties van chemische reacties
Rekening houdend met chemische reacties samen met hun energievraag en -verdeling, worden hun specifieke warmte-effecten opgenomen in de notatie van een chemische vergelijking. Voor exotherme reacties wordt de absolute waarde van het bestaande warmte-effect vermeld op de productzijde. Omgekeerd wordt bij het noteren van een endotherme reactie aan de substraatzijde de absolute waarde van de opgenomen energie genoteerd. Om een voorbeeld te geven:
- Exotherme reactie:
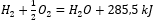
- Endotherme reactie: 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Een andere manier is om een chemische vergelijking op te schrijven samen met de gegeven energie-effectwaarde. In dit geval is de waarde die de energie van een exo-energe reactie vertegenwoordigt negatief, terwijl deze positief is voor een endo-energe reactie. Bijvoorbeeld:
- Exoenergische reactie: Fe + S → FeS ∆H= -95,2 kJ/mol
- Endoenergische reactie: FeS → Fe + S ∆H= 95,2 kJ/mol
De wet van Hess
Het vormt een basis voor thermochemische berekeningen en stelt dat het warmte-effect altijd hetzelfde is, ongeacht de manier waarop de reactie wordt uitgevoerd. Dit stelt ons in staat om de standaardenthalpie van een reactie (Δ r H ϴ ) te berekenen, uitgaande van standaardomstandigheden, dat wil zeggen een druk van 10 5 Pa en een willekeurige temperatuur. Aangezien enthalpie een toestandsfunctie is, hangt de variabiliteit ervan af van slechts twee waarden: in de begin- en eindtoestand, die in een chemische reactie respectievelijk de toestand van substraten en de toestand van producten vertegenwoordigt. De wet van Hess wordt uitgedrukt door een vergelijking die stechiometrische coëfficiënten (v) en standaard molaire vormingsenthalpieën (Δ f H ϴ ) bevat: 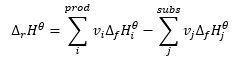
Standaard molaire vormingsenthalpie
Het is een enthalpie die wordt verkregen door 1 mol van een bepaalde chemische verbinding te vormen uit elementen in hun basistoestand. De basistoestand is de meest duurzame variant van het element onder specifieke omstandigheden. Om een voorbeeld te geven, grafiet is de meest duurzame variant van koolstof bij 25 o C en 10 5 Pa. Omgekeerd, bij hoge temperatuur en druk is diamant een stabiele vorm van koolstof. Voor elke reactant die deelneemt aan een reactie in zijn basisconditie, is de waarde van de standaard molaire vormingsenthalpie nul. Meestal zijn dit individuele atomen van edelgassen of de meest duurzame varianten van andere gassen in specifieke omstandigheden. Voor een standaard druk (10 5 Pa) en temperatuur (normaal 25 o C), zijn de waarden van standaard molaire enthalpieën van vorming van verbindingen verzameld in chemische tabellen. De eenheid van die waarde is . De wet van Hess toegepast op chemische reacties houdt in dat de enthalpiewaarde van de reactie onafhankelijk is van het aantal tussenliggende reacties. De enige belangrijke informatie is dat bepaalde substraten worden gebruikt om bepaalde producten te verkrijgen.
De synthese van koolstofdioxide
De synthese van koolstofdioxide kan op verschillende manieren worden uitgevoerd, maar volgens de wet van Hess leidt elk van hen tot dezelfde waarde van veranderingen in standaardenthalpieën.
- Directe synthese
- De synthese van koolstof(II)oxide + oxidatie van de verbinding tot koolstof(IV)oxide
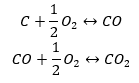 Wanneer we de waarden van de standaard vormingsenthalpieën van de verbindingen uit de tabel lezen en ze in de chemische vergelijkingen vervangen, zullen we zien dat de enthalpie voor elke methode hetzelfde is: -393,5 kJ/mol.
Wanneer we de waarden van de standaard vormingsenthalpieën van de verbindingen uit de tabel lezen en ze in de chemische vergelijkingen vervangen, zullen we zien dat de enthalpie voor elke methode hetzelfde is: -393,5 kJ/mol.
Wet van Kirchhoff
Het stelt ons in staat om de berekeningen te transformeren om de standaardenthalpie van een reactie voor een bepaalde temperatuur te berekenen, als we de waarde ervan kennen bij een andere temperatuur. We kennen ook de relaties tussen de molaire warmte van alle reactanten en de temperatuur. De wet kan worden toegepast, aangezien de verandering in de enthalpie van de reactie afhangt van de omstandigheden waarin deze werd bepaald: deze varieert samen met veranderende temperatuur en druk. De afleiding van de formule moet worden gestart door de thermische capaciteit te definiëren, dat is de verhouding tussen toegevoerde warmte en temperatuurstijging: ![]() Uitgaande van isotherme omstandigheden kunnen we de volgende transformatie maken:
Uitgaande van isotherme omstandigheden kunnen we de volgende transformatie maken: ![]() Integratie van de resulterende vergelijking en de omzetting van thermische capaciteit in het deel dat de verandering in standaard thermische capaciteit vertegenwoordigt, wordt weerspiegeld door de vergelijking van de wet van Kirchhoff:
Integratie van de resulterende vergelijking en de omzetting van thermische capaciteit in het deel dat de verandering in standaard thermische capaciteit vertegenwoordigt, wordt weerspiegeld door de vergelijking van de wet van Kirchhoff: 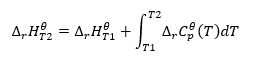 Voor standaardomstandigheden wordt de verandering in de thermische capaciteit van een reactie bepaald door de vergelijking met v-variabelen, zijnde stechiometrische factoren, en , die de standaard molaire warmte van een bepaalde reactant vertegenwoordigt. Wanneer het temperatuurverschil klein is (tot 100K), wordt aangenomen dat de waarde van de standaard molaire warmte van de reactant binnen een bepaald bereik constant is. Dan kunnen we de vereenvoudigde vorm van de wet van Kirchhoff gebruiken, ervan uitgaande dat de thermische capaciteiten van de reactanten niet afhangen van de temperatuur maar van constante druk:
Voor standaardomstandigheden wordt de verandering in de thermische capaciteit van een reactie bepaald door de vergelijking met v-variabelen, zijnde stechiometrische factoren, en , die de standaard molaire warmte van een bepaalde reactant vertegenwoordigt. Wanneer het temperatuurverschil klein is (tot 100K), wordt aangenomen dat de waarde van de standaard molaire warmte van de reactant binnen een bepaald bereik constant is. Dan kunnen we de vereenvoudigde vorm van de wet van Kirchhoff gebruiken, ervan uitgaande dat de thermische capaciteiten van de reactanten niet afhangen van de temperatuur maar van constante druk: ![]()
