De pH-schaal wordt gebruikt om de zuurgraad of alkaliteit van een oplossing te bepalen op een kwantitatieve schaal die de absolute getallen van 0 tot 14 bevat. Het is gebaseerd op de molaire activiteit van hydroniumionen [H 3 O +] in de geteste vloeistof. De schaal is in 1909 ontwikkeld door de Deense biochemicus S. Sorensen, en de letters 'p' en 'H' staan respectievelijk voor het Latijnse 'potentio' (kracht) en het waterstofatoom, dat wordt aangeduid in het periodiek systeem als 'H' (waterstof). De pH-schaal weerspiegelt zowel het een als het ander: om de pH-waarde te bepalen gebruiken we de machtsexponent met een gewijzigd teken om te verwijzen naar de protonen die waterstof bevatten. De pH-waarde van elke geproduceerde oplossing is een van de belangrijkste chemische kenmerken en een factor die het verloop en de snelheid van veel chemische reacties bepaalt, evenals het type geproduceerde stoffen.

Differentiatie op de schaal
De pH-schaal omvat vijftien graden, waarbij de middelste waarde (7) een neutrale pH aangeeft. Oplossingen die dicht bij 0 zijn gepositioneerd, worden sterke zuren genoemd, terwijl die aan de andere kant, dicht bij 14, sterke basen worden genoemd. Een zure pH betekent dat de oplossing te veel waterstofionen bevat [H 3 O +], en een basische pH betekent dat er te veel hydroxide-ionen zijn [OH –]. De pH-schaal wordt het vaakst genoemd in de context van oplossingen, maar het absolute chemische potentieel van een proton maakt het toepasbaar in alle aggregatietoestanden. Hierdoor kunnen we het alkaliteitsniveau van vrijwel elke stof direct vergelijken.
Zelfdissociatie van water
Om de betekenis van de pH-schaal volledig te begrijpen, hebben we de spontane reactie van zelfdissociatie van water nodig, die verloopt volgens de volgende vergelijking:  Het is een omkeerbaar proces waarvan de evenwichtsconstante naar de linkerkant van de vergelijking wordt verschoven, dat wil zeggen naar niet-gedissocieerd water.
Het is een omkeerbaar proces waarvan de evenwichtsconstante naar de linkerkant van de vergelijking wordt verschoven, dat wil zeggen naar niet-gedissocieerd water.
Hoe de pH-waarde berekenen?
Ondanks de foutief gedefinieerde initiële veronderstelling dat de bepaling betrekking heeft op de concentratie van waterstofionen [H +], is de meest populaire formule nog steeds de volgende:  Tegenwoordig weten we al dat oplossingen geen waterige waterstofionen bevatten, dwz protonen die in water aanwezig zijn, vanwege het onmiddellijke solvatatieproces. Het fenomeen resulteert in het ontbreken van vrije protonen en de aanwezigheid van hydroniumionen [H 3 O +], die wordt veroorzaakt door de spontane, onomkeerbare reactie:
Tegenwoordig weten we al dat oplossingen geen waterige waterstofionen bevatten, dwz protonen die in water aanwezig zijn, vanwege het onmiddellijke solvatatieproces. Het fenomeen resulteert in het ontbreken van vrije protonen en de aanwezigheid van hydroniumionen [H 3 O +], die wordt veroorzaakt door de spontane, onomkeerbare reactie: 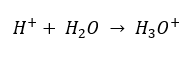 Daarom is de juiste notatie van de formule als volgt:
Daarom is de juiste notatie van de formule als volgt: 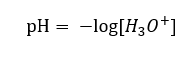
Omgeving aangegeven op de pH-schaal
Aangenomen wordt dat de concentratie van hydroniumionen in zuiver water bij kamertemperatuur (25 o C) 10 -7 mol/dm 3 is, dus de pH-waarde kan als volgt worden berekend: 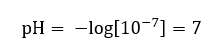 Dit komt overeen met het feit dat water, dat neutraal is, zich in het midden van de schaal bevindt, wat wijst op de chemische inertie van de stof. Het bewijst ook dat water een gelijk aantal hydroxide-anionen en hydronium-kationen bevat. Bij zuren en basen is dat evenwicht echter verstoord. Een negatieve exponent suggereert een relatie waarbij hoe lager de pH-waarde, hoe hoger de kracht van de geteste oplossing. De term ‘power’ in de context van de pH-schaal verwijst naar het feit dat waarde 0 wordt ingenomen door sterke, zelfs irriterende zuren, terwijl waarde 14 verwijst naar de sterkst alkalische stoffen.
Dit komt overeen met het feit dat water, dat neutraal is, zich in het midden van de schaal bevindt, wat wijst op de chemische inertie van de stof. Het bewijst ook dat water een gelijk aantal hydroxide-anionen en hydronium-kationen bevat. Bij zuren en basen is dat evenwicht echter verstoord. Een negatieve exponent suggereert een relatie waarbij hoe lager de pH-waarde, hoe hoger de kracht van de geteste oplossing. De term ‘power’ in de context van de pH-schaal verwijst naar het feit dat waarde 0 wordt ingenomen door sterke, zelfs irriterende zuren, terwijl waarde 14 verwijst naar de sterkst alkalische stoffen.
De toevoeging van zuur aan water
Een pH-verandering van een neutraal niveau kan worden veroorzaakt door toevoeging van stoffen met verschillende vermogens. Als we bijvoorbeeld een van de sterkste zuren ( zoutzuur, HCl ) aan water toevoegen, zal het zuur dissociëren volgens de volgende reactie:  In tegenstelling tot de zelfdissociatie van water, is het evenwicht van de zuurdissociatie aanzienlijk naar rechts verschoven. Daarom, als dat zuur wordt opgelost in inert water voor het milieu, zal het de hoeveelheid hydroniumionen in het water vergroten en als gevolg daarvan hun molaire activiteit verhogen. Om een voorbeeld te geven: volgens de dissociatiereactie introduceert zoutzuur geconcentreerd bij 1 mol/ dm3 in de oplossing hydroniumionen geconcentreerd bij 1 mol/ dm3 . De pH-waarde van zo’n zoutzuuroplossing kan worden berekend aan de hand van de volgende formule:
In tegenstelling tot de zelfdissociatie van water, is het evenwicht van de zuurdissociatie aanzienlijk naar rechts verschoven. Daarom, als dat zuur wordt opgelost in inert water voor het milieu, zal het de hoeveelheid hydroniumionen in het water vergroten en als gevolg daarvan hun molaire activiteit verhogen. Om een voorbeeld te geven: volgens de dissociatiereactie introduceert zoutzuur geconcentreerd bij 1 mol/ dm3 in de oplossing hydroniumionen geconcentreerd bij 1 mol/ dm3 . De pH-waarde van zo’n zoutzuuroplossing kan worden berekend aan de hand van de volgende formule: 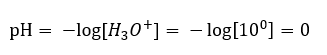
De toevoeging van een base aan water
In het tegenovergestelde geval, waar we een sterke base aan water toevoegen, zal de concentratie van hydroniumionen dalen. Natriumhydroxide geconcentreerd bij 1mol/dm 3 zal bijvoorbeeld analoog dezelfde concentratie hebben, maar dan van andere ionen (hydroxide-ionen), afhankelijk van de reactie die het ondergaat onder invloed van water:  In dat geval is het mogelijk om indirect de pH te berekenen met behulp van de volgende aanvullende pOH-formule:
In dat geval is het mogelijk om indirect de pH te berekenen met behulp van de volgende aanvullende pOH-formule: 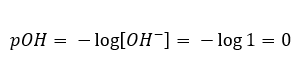 Als we weten dat:
Als we weten dat: 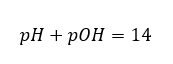 we kunnen gemakkelijk berekenen dat de pH van de oplossing van een sterke base (NaOH) geconcentreerd bij 1 mol/dm 3 een pH van 14 heeft.
we kunnen gemakkelijk berekenen dat de pH van de oplossing van een sterke base (NaOH) geconcentreerd bij 1 mol/dm 3 een pH van 14 heeft. 
Het pH-niveau van de weegschaal?
Aangezien de pH-schaal oorspronkelijk is ontwikkeld voor verdunde oplossingen, is het mogelijk dat sterke zuren of basen deze overschrijden, onder 0 of boven 14. Dit komt omdat de schaal nutteloos is voor hoge concentraties waarbij de pH niet langer logaritmisch is. functie van hydroniumionen [H 3 O +]. Dan gebruiken we verschillende waarden, die voortkomen uit constante evenwichten van de dissociatie van zuren en basen.
Methoden om de pH-waarde van de oplossing te bepalen
Om de pH van een omgeving empirisch te bepalen, gebruiken we de zogenaamde zuur-base-indicatoren. In de praktijk zijn het stoffen die van kleur veranderen als ze worden beïnvloed door verschillende pH-omstandigheden. Er zijn drie soorten van dergelijke indicatoren:
- Indicatoren die in een basisomgeving van kleur veranderen, bijvoorbeeld:
- kleurloze fenolftaleïne wordt frambooskleurig,
- kleurloos thymolphtaleïne wordt blauw.
- Indicatoren die van kleur veranderen in een zure omgeving, bijvoorbeeld:
- methyloranje verandert van kleur van oranje naar rood,
- broomthymolblauw verandert van kleur van blauw naar geel.
- Universele indicatoren, bijvoorbeeld:
- broomthymolblauw wordt geel in zuren en blauw in basen,
- lacmus wordt rood in zuren of blauw in basen.
Het is ook gebruikelijk om lakmoespapier te weken in een mengsel van verschillende indicatorstoffen, waardoor het bereik van de pH-waarden toeneemt. Bovendien gebruiken veel laboratoria kant-en-klare, universele lakmoespapieren die van kleur veranderen in het bereik van rood naar groen, wat de geteste pH passend suggereert op basis van een bijbehorende schaal. Met een dergelijke bepaling kunnen we alleen de pH-waarde schatten met een nauwkeurigheid van 0,5 eenheid op de pH-schaal. Een nauwkeurigere methode voor het meten van de pH-waarde is de zuur-base-titratie, die de subtypes alkalimetrie (titratie met een gestandaardiseerde basisoplossing) en acidimetrie (titratie met een gestandaardiseerde zuuroplossing) omvat. Het gebruikt een titrant met een bekende concentratie, die bij reactie met de geteste stof continu de concentratie van hydroniumionen in de oplossing varieert. Een dergelijke bepaling kan op twee manieren worden uitgevoerd: visueel, bij het bepalen van het eindpunt, samen met de kleurverandering of met behulp van instrumentele methoden, bijvoorbeeld potentiometrie of conductometrie. Zoals de naam al doet vermoeden, stelt het gebruik van een pH-meter ons ook in staat om de pH-waarde van de stof te bepalen. Het instrument, werkend op basis van potentiometrie, heeft een cel in twee identieke elektroden. Een daarvan, de indicatorelektrode genaamd, moet in de geteste oplossing worden geplaatst. De andere (vergelijkende elektrode) wordt in de standaardoplossing met bekende pH-waarde geplaatst. Een veelgebruikte stof is de zilverchloride-oplossing. Beide elektroden zijn verbonden met een uiterst gevoelige voltmeter, die de EMF (elektromotorische kracht) continu omzet in een bepaald resultaat in de pH-schaal. Volgens de Nernst-theorie is de elektromotorische kracht (EMF) van de cel, bestaande uit twee identieke elektroden ondergedompeld in oplossingen met verschillende pH-waarden, recht evenredig met de logaritme van het quotiënt van beide concentraties.
Thuis methoden voor het meten van de pH-waarde
Het blijkt dat er veel natuurlijke pH-indicatoren zijn en dat de geschatte pH-waarde in de thuisomgeving kan worden gemeten. Een aftreksel van zwarte theebladeren wordt bijvoorbeeld helderder wanneer het wordt gemengd met een zuur, bijvoorbeeld citroensap. Omgekeerd wordt het donkerder onder invloed van basen zoals een oplossing van baking soda. Rodekoolsap verandert van kleur van violet naar rood wanneer het wordt blootgesteld aan een zuur, of naar blauw wanneer het wordt gemengd met een base.
