Dissociatie, in chemische context, betekent de ontleding van een stof in andere moleculen. Het woord komt van de Latijnse term " dissociatio ", wat "scheiding" betekent. In de wetenschappelijke nomenclatuur heeft dissociatie verschillende definities, zoals het ook zijn specifieke betekenis heeft in de psychologie. Maar laten we ons concentreren op wat dissociatie betekent in de chemie. Afhankelijk van het verloop van het proces en de gebruikte stof kunnen we vier verschillende soorten dissociatie onderscheiden. De meest populaire is elektrolytische dissociatie, hoewel thermische dissociatie even belangrijk is.

Thermische dissociatie
Het proces bestaat uit de ontbinding van moleculen in kleinere moleculen of in atomen, onder invloed van temperatuur. De belangrijkste relatie is het feit dat de temperatuur die wordt gebruikt voor dissociatie lager kan zijn als de verbinding zwakkere chemische bindingen bevat. Degenen met een hogere energie die nodig is voor ontbinding hebben een hogere temperatuur nodig. Een bekend voorbeeld van thermolyse (thermische dissociatie) is de karamelisatie van sucrose, die plaatsvindt bij 160 o C.
Elektrolytische dissociatie
Ontdekt in 1887 door de Zweedse chemicus Svante Arrhenius, is het iets complexer in vergelijking met thermische dissociatie. Elektrolytische dissociatie bestaat uit de ontleding van een stof, die optreedt wanneer een oplosmiddel (meestal water) vrij bewegende ionen aantast. Arrhenius heeft in zijn onderzoek bewezen dat de ionen die door een dergelijke dissociatie worden geproduceerd ervoor zorgen dat de oplossing elektriciteit geleidt. Dit was de basis voor de ontwikkeling van de classificatie van chemische stoffen in elektrolyten (oplossingen die elektrische stroom kunnen geleiden) en niet-elektrolyten (oplossingen die geen elektrische stroom kunnen geleiden).
Elektrolyten
De term "elektrolyten" heeft twee betekenissen: vanuit technisch oogpunt is het elke stof die ionisch een lading tussen elektroden kan overbrengen. Als gevolg hiervan kan het elektrische stroom ionisch geleiden. De andere, meer chemische betekenis van die term verwijst naar stoffen die elektrolytische dissociatie ondergaan als gevolg van smelten of oplossen. Dergelijke oplossingen (meestal waterig) geleiden ook elektriciteit. Voorbeelden van dergelijke elektrolyten zijn ionische verbindingen, zoals natriumchloride (tafelzout), maar ook niet-ionische verbindingen, bijvoorbeeld zoutzuur of kaliumhydroxide . Gezien hun specifieke eigenschappen kunnen elektrolyten elektrische geleiders worden genoemd. Deze kunnen worden onderverdeeld in geleiders van klasse 1 (metalen, hun legeringen en koolstof) en geleiders van klasse 2 (oplossingen van basen, zuren en zouten ).
Het mechanisme van elektrolytische dissociatie
In een oplosmiddel waarvan de diëlektrische constante hoog is (bijv. 81 voor water), worden de wederzijdse aantrekkingskrachten tussen ionen in een kristallijn netwerk aanzienlijk verminderd. Dit is wanneer de ionen afbreken, waardoor de stof oplost en vrij bewegende ionen in de oplossing afscheidt. Dergelijke processen vinden ook plaats door de interactie tussen ionen en watermoleculen, die een gevolg is van een polaire structuur van H 2 O. Volgens Nekrasov wordt het werkingsmechanisme van water tijdens de ontbinding van een elektrolyt met een ionische structuur gestart door het positieve ion van de stof, dat de tegenovergestelde pool van het watermolecuul aantrekt en tegelijkertijd het positieve ion wegduwt. De tegenpool werkt op dezelfde manier en beide ionen worden omringd door de watermoleculen die ze hebben aangetrokken. Een dergelijke aantrekking vindt plaats in beide richtingen tussen dipolaire moleculen en ionen, waardoor de aantrekkingskracht van ionen in het elektrolyt veel lager is. Het mechanisme kan dus worden onderverdeeld in vier hoofdfasen: de overgang van polaire naar ionische structuur, de vorming van de ionische structuur en de hydratatie van ionen. De verbindingen tussen de ionen en het oplosmiddel, geproduceerd door dissociatie, worden solvaten genoemd. Als water het oplosmiddel is, worden ze hydraten genoemd.
De hydratatieschaal
Het is een omhulsel dat is samengesteld uit watermoleculen die zich het dichtst bij het ion bevinden, georiënteerd met hun tegenovergestelde polen. Vrije, geladen polen trekken nog meer waterlagen aan, totdat de aantrekkingskracht van het ion zwakker wordt dan de moleculaire bewegingsenergie in de oplossing. De schaal vergemakkelijkt de afbraak van elektrolytmoleculen in kationen en anionen en vormt een barrière die het opnieuw verbinden van ionen om moleculen te vormen verhindert. 
Dissociatie van zuren en basen: de wet van massale actie
Sterke zuren zijn de zuren die verregaande dissociatie vertonen in een waterige oplossing, en zwakke zuren zijn die welke slechts in geringe mate dissociëren. Als we de sterkte van verschillende zuren vergelijken, moeten we ook rekening houden met enkele factoren, zoals de neiging van zuurmoleculen om hun protonen af te staan, of de concentratie van de stof in kwestie. Er is echter een chemische waarde die niet afhankelijk is van de concentratie, maar die de individuele eigenschappen van moleculen uitstekend karakteriseert: de dissociatieconstante. Het afleiden van de vergelijking voor die waarde moet worden gestart door de vergelijking voor zuurdissociatie op te schrijven. Voor een voorbeeld met een enkel proton (HX) ziet het er als volgt uit: ![]() Als de oplossing verdund is en het zuur zwak is, kunnen we de wet van massale actie toepassen, die als volgt wordt uitgedrukt:
Als de oplossing verdund is en het zuur zwak is, kunnen we de wet van massale actie toepassen, die als volgt wordt uitgedrukt: 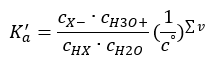 Er zijn twee manieren om de gepresenteerde relatie korter te maken. De eerste stap is om aan te nemen dat de waterconcentratie constant is. We kunnen ook het symbool c o weglaten, omdat het een standaardconcentratie uitdrukt die gelijk is aan 1 mol/dm 3 . Wel is het belangrijk om het in de beginformule te plaatsen en er rekening mee te houden bij het bepalen van de eenheid. Dit komt omdat chemische constanten dimensieloze waarden zijn. Ondertussen zijn alle in de formule gebruikte concentraties uitgedrukt in mol/dm 3 . Dan krijgen we uiteindelijk de formule voor de dissociatieconstante:
Er zijn twee manieren om de gepresenteerde relatie korter te maken. De eerste stap is om aan te nemen dat de waterconcentratie constant is. We kunnen ook het symbool c o weglaten, omdat het een standaardconcentratie uitdrukt die gelijk is aan 1 mol/dm 3 . Wel is het belangrijk om het in de beginformule te plaatsen en er rekening mee te houden bij het bepalen van de eenheid. Dit komt omdat chemische constanten dimensieloze waarden zijn. Ondertussen zijn alle in de formule gebruikte concentraties uitgedrukt in mol/dm 3 . Dan krijgen we uiteindelijk de formule voor de dissociatieconstante: 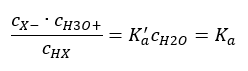 De relatie die de zuurdissociatieconstante (Ka) uitdrukt, bestaat uit experimenteel bepaalde waarden die binnen het bereik van 10-10 tot 108 vallen. Een populaire bewerking is het gebruik van een logaritmische formule, uitgedrukt als een negatieve logaritme van de dissociatieconstante, aangeduid als pK a : pK a = -logK a Het is belangrijk dat lage Ka-waarden zwakke zuren vertegenwoordigen en hoge waarden sterke zuren verandert de pKa in de tegenovergestelde richting. Lage, meestal negatieve pKa-waarden komen overeen met sterke zuren. Positieve, hoge pKa -waarden vertegenwoordigen zwakke zuren. Wanneer we een ander concept introduceren, de mate van dissociatie (α), wat de verhouding is van het aantal molen van de moleculen van een bepaalde verbinding, die dissociatie ondergaan (ontleding in ionen), tot het totale aantal molen van de moleculen van die verbinding, aanwezig in de oplossing, kunnen we de vergelijking verder ontwikkelen. Als we de zeer lage concentratie van waterstofionen, gevormd door waterdissociatie, buiten beschouwing laten en de evenwichtsconcentraties van ionen en moleculen gebruiken, kunnen we aannemen dat:
De relatie die de zuurdissociatieconstante (Ka) uitdrukt, bestaat uit experimenteel bepaalde waarden die binnen het bereik van 10-10 tot 108 vallen. Een populaire bewerking is het gebruik van een logaritmische formule, uitgedrukt als een negatieve logaritme van de dissociatieconstante, aangeduid als pK a : pK a = -logK a Het is belangrijk dat lage Ka-waarden zwakke zuren vertegenwoordigen en hoge waarden sterke zuren verandert de pKa in de tegenovergestelde richting. Lage, meestal negatieve pKa-waarden komen overeen met sterke zuren. Positieve, hoge pKa -waarden vertegenwoordigen zwakke zuren. Wanneer we een ander concept introduceren, de mate van dissociatie (α), wat de verhouding is van het aantal molen van de moleculen van een bepaalde verbinding, die dissociatie ondergaan (ontleding in ionen), tot het totale aantal molen van de moleculen van die verbinding, aanwezig in de oplossing, kunnen we de vergelijking verder ontwikkelen. Als we de zeer lage concentratie van waterstofionen, gevormd door waterdissociatie, buiten beschouwing laten en de evenwichtsconcentraties van ionen en moleculen gebruiken, kunnen we aannemen dat: 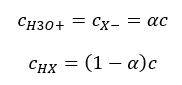 Dan kan de dissociatieconstante als volgt worden genoteerd:
Dan kan de dissociatieconstante als volgt worden genoteerd:  In deze vorm is het de afhankelijkheid van de mate van dissociatie van een elektrolyt van zijn concentratie, dwz de verdunningswet van Ostwald. Als we zeer zwakke elektrolyten analyseren, kan de mate van dissociatie (α) worden aangenomen als <<1, en kan de formule worden vereenvoudigd tot het volgende:
In deze vorm is het de afhankelijkheid van de mate van dissociatie van een elektrolyt van zijn concentratie, dwz de verdunningswet van Ostwald. Als we zeer zwakke elektrolyten analyseren, kan de mate van dissociatie (α) worden aangenomen als <<1, en kan de formule worden vereenvoudigd tot het volgende:  Zuren die meer dan één proton bevatten ondergaan dissociatie in meerdere stadia, en we moeten rekening houden met al zijn stadia. Om een voorbeeld te geven, voor orthofosforzuur zijn er drie stadia:
Zuren die meer dan één proton bevatten ondergaan dissociatie in meerdere stadia, en we moeten rekening houden met al zijn stadia. Om een voorbeeld te geven, voor orthofosforzuur zijn er drie stadia:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Elke fase heeft zijn eigen evenwichtsconstante, die analoog aan de eerste kan worden genoteerd:  Dissociatieconstanten zijn getabelleerd, zowel voor hydraciden als voor oxyzuren.
Dissociatieconstanten zijn getabelleerd, zowel voor hydraciden als voor oxyzuren.
| Zuur | K een | pK een |
| HF | 6,3·10 -4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27.54 | -1.44 |
| H 3 PO 4 | 6,9·10 -3 | 2.16 |
Tabel 1. Voorbeeldwaarden van dissociatieconstanten voor zuren. Het is vergelijkbaar voor de stabilisatie van het evenwicht van basen tijdens dissociatie. Rekening houdend met de voorbeeldregel B, kan de vergelijking als volgt worden genoteerd: ![]() Als we vervolgens een dissociatieconstante voor een base willen afleiden, gebruikmakend van de wet van massale actie en ervan uitgaande dat de waterconcentratie in de verdunde oplossing vrijwel constant is, krijgen we de volgende formule:
Als we vervolgens een dissociatieconstante voor een base willen afleiden, gebruikmakend van de wet van massale actie en ervan uitgaande dat de waterconcentratie in de verdunde oplossing vrijwel constant is, krijgen we de volgende formule:  Hoe sterker de base, hoe hoger de dissociatieconstante en hoe lager de pKb -waarde, terwijl hoe lager de dissociatieconstante en hoe hoger de pKb -waarde, hoe zwakker de base.
Hoe sterker de base, hoe hoger de dissociatieconstante en hoe lager de pKb -waarde, terwijl hoe lager de dissociatieconstante en hoe hoger de pKb -waarde, hoe zwakker de base.
| Baseren | Kb | p K b |
| Hydrazine | 3·10 -6 | 5.5 |
| Ammoniak | 1.78·10 -5 | 4,75 |
| Methylamine | 5.0·10 -4 | 3.3 |
Tabel 2. Voorbeeldwaarden van dissociatieconstanten voor basen. 
Wat bepaalt de sterkte van zuren
Als we de uitdrukkingen van dissociatieconstanten voor bepaalde zuren kennen, kunnen we een paar echte aannames doen:
- De sterkte van een hydracid neemt toe met het toenemende atoomnummer van het element dat is verbonden met het waterstofatoom.
- De sterkte van een hydracid neemt af samen met de toenemende elektronegativiteit van het element dat aan het waterstofatoom is bevestigd. Dit kan misleidend zijn, aangezien in theorie de toenemende elektronegativiteit de abstractie van protonen zou moeten bevorderen.
- De grootte van het tijdens dissociatie gevormde anion beïnvloedt de dissociatieconstante in grotere mate dan de elektronegativiteit.
Zelfdissociatie van water
Een interessant voorbeeld van dissociatie is de ontleding van watermoleculen. Omdat ze in staat zijn om zowel protonen aan te trekken als ze af te geven, ondergaat zuiver water in geringe mate zelfdissociatie, volgens de volgende vergelijking: H 2 O + H 2 O ↔ H 3 O + + OH – Zoals voor zuren en basen, is het ook mogelijk om de wet van massale actie toe te passen, die evenwichtsconcentraties van niet-gedissocieerd water omvat, evenals zijn anionen en kationen: 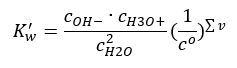 Het blijkt dat de concentraties van H 3 O + kationen en OH – anionen zo klein zijn in vergelijking met niet-gedissocieerd water dat zelfs hun verandering praktisch niets verandert aan de concentratie van niet-gedissocieerd water. Dit maakt het mogelijk om aan te nemen dat die waarde constant is en de vergelijking om te zetten in de volgende vorm: K w = c OH – · c H3O + Het is een bijzonder belangrijk aspect in de context van chemische berekeningen, en zo’n constante wordt aangeduid als het ionische product van water. Het wordt ook vaak gebruikt als een negatieve logaritme, aangeduid als pKw . Dit is gelijk aan –logK w . Gebaseerd op de vergelijking, als het ionische evenwicht van water wordt verstoord als gevolg van de toevoer van H 3 O + ionen, dan moeten we, om de constantheid van het ionische product te behouden, de concentratie van OH – ionen verlagen. Evenzo vermindert een overmaat aan OH – ionen de concentratie van kationen. Het product van deze concentraties moet constant zijn. Experimenten hebben aangetoond dat Kw bij een temperatuur van 298K 10 -14 is. Daarom kunnen we de vergelijking die geldig is voor zuiver water ook als volgt noteren:
Het blijkt dat de concentraties van H 3 O + kationen en OH – anionen zo klein zijn in vergelijking met niet-gedissocieerd water dat zelfs hun verandering praktisch niets verandert aan de concentratie van niet-gedissocieerd water. Dit maakt het mogelijk om aan te nemen dat die waarde constant is en de vergelijking om te zetten in de volgende vorm: K w = c OH – · c H3O + Het is een bijzonder belangrijk aspect in de context van chemische berekeningen, en zo’n constante wordt aangeduid als het ionische product van water. Het wordt ook vaak gebruikt als een negatieve logaritme, aangeduid als pKw . Dit is gelijk aan –logK w . Gebaseerd op de vergelijking, als het ionische evenwicht van water wordt verstoord als gevolg van de toevoer van H 3 O + ionen, dan moeten we, om de constantheid van het ionische product te behouden, de concentratie van OH – ionen verlagen. Evenzo vermindert een overmaat aan OH – ionen de concentratie van kationen. Het product van deze concentraties moet constant zijn. Experimenten hebben aangetoond dat Kw bij een temperatuur van 298K 10 -14 is. Daarom kunnen we de vergelijking die geldig is voor zuiver water ook als volgt noteren:  Dissociatie is ook gerelateerd aan de pH-waarde van de oplossing. Oplossingen met gelijke concentraties H 3 O + kationen en OH – anionen vertonen een neutrale pH. In zure oplossingen is de concentratie van kationen hoger dan 10 -7 mol/l, terwijl deze in alkalische oplossingen lager is dan 10 -7 mol/l.
Dissociatie is ook gerelateerd aan de pH-waarde van de oplossing. Oplossingen met gelijke concentraties H 3 O + kationen en OH – anionen vertonen een neutrale pH. In zure oplossingen is de concentratie van kationen hoger dan 10 -7 mol/l, terwijl deze in alkalische oplossingen lager is dan 10 -7 mol/l.
